��Ŀ����
����Ŀ�������ӵ�����ڳɱ��͡���Դ�ḻ����Ϊȡ������ӵ���ڴ��ģ��������Ӧ�õ�����ѡ����Ϊ�����ӵ�ص���������֮һ����״̼����K3V2(PO4)3�����ߵ缫���ϳ�Ϊ��ע����֮һ�����Ʊ�����������ͼ��
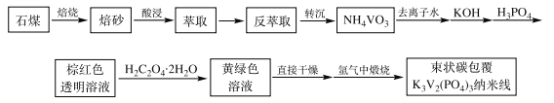
�����ϣ�
��ʯú����Ҫ�ɷ�ΪV2O3������Al2O3��CaO��Fe2O3�����ʡ�
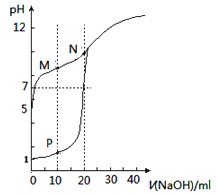
��+5�۷�����Һ�е���Ҫ������ʽ����ҺpH�Ĺ�ϵ���±���
![]()
��1��K3V2(PO4)3��V�Ļ��ϼ�Ϊ___��
��2������ʱ����ʯú�м���ʯ�ң���V2O3ת��ΪCa(VO3)2��
��Ϊ����߱��չ���������Ч�ʣ��������ղ��跽����������___��
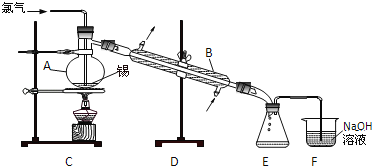
a.�ڻ�תҤ���и������գ���ȼ������Ϊú������0.5~2��
b.���չ����У��ڱ��������м��븨�����������������ɶȺ�����
c.Ҥ����зֶο���
d.�����ϲ���ΪҤ���2/3�߶�
�ڱ��չ�������Ҫ��Ӧ�Ļ�ѧ����ʽΪ__________��
��3��ʵ��ʱ��NH4VO3��KOH��H3PO4�����ʵ����ֱ�Ϊ5mmol��7.5mmol��7.5mmol�����ܽ���20mLȥ����ˮ�У���Һ��ɫ����Ϊ��ɫ���ǡ���ɫ���������غ�ɫ����Һ������ټ���H2C2O4��2H2O����������Һ��Ϊ����ɫ�����������K3V2(PO4)3��ò��Ӱ�����£�

��ʵ����������״̼����K3V2(PO4)3��������Ʒ�Ʊ����������Ϊ___��
�����������dz��õĻ�ԭ������ʵ���в������������ƴ�����ᾧ�壬ԭ����___��
��4������IJ��ᾧ���ǹ����ģ�����ֻ��![]() �IJ���Ϊ��ԭ������VO3-��ԭ��VO2+��
�IJ���Ϊ��ԭ������VO3-��ԭ��VO2+��![]() �IJ�����C2O42-����ʽ���ڣ��˹����з�Ӧ�����ӷ���ʽΪ___��
�IJ�����C2O42-����ʽ���ڣ��˹����з�Ӧ�����ӷ���ʽΪ___��
��5���������������ʱ�������������___��
��6��ij�������������������̣���10tʯú������״̼����K3V2(PO4)3������0.8064t�������������з����ܻ�����Ϊ80%����ʯú�з�Ԫ�ص���������Ϊ___��
���𰸡�+3 a��b��c ![]() ��������Ϊ6.0g �����ںϳ���״̼����K2V2(PO4)3�����ߵĹ����в�������ԭ����Ӱ������ò
��������Ϊ6.0g �����ںϳ���״̼����K2V2(PO4)3�����ߵĹ����в�������ԭ����Ӱ������ò ![]() ��ֹK2V2(PO4)3������ 2.04%
��ֹK2V2(PO4)3������ 2.04%
��������
ʯú����Ҫ�ɷ�ΪV2O3������Al2O3��CaO��Fe2O3�����ʣ��ڿ����б��գ�����Ca(VO3)2������������������Fe3+��Al3+��Ca2+��![]() �ȣ�������ȡ������
�ȣ�������ȡ������![]() ��������ȡ��Ȼ����з���ȡ��������
��������ȡ��Ȼ����з���ȡ��������![]() �������ᴿ����������Һ�м������������NH4VO3��NH4VO3��KOH��H3PO4��Ӧ��õ��غ�ɫ����
�������ᴿ����������Һ�м������������NH4VO3��NH4VO3��KOH��H3PO4��Ӧ��õ��غ�ɫ����![]() ��Һ��Ȼ������Һ�м���������ᾧ�巢��������ԭ��Ӧ����
��Һ��Ȼ������Һ�м���������ᾧ�巢��������ԭ��Ӧ����![]() ��ԭ��VO2+��Ȼ����и��������������������Ʊ���״̼����K3V2(PO4)3�����ߣ��Դ˽��
��ԭ��VO2+��Ȼ����и��������������������Ʊ���״̼����K3V2(PO4)3�����ߣ��Դ˽��
��1��K3V2(PO4)3��KԪ�ػ��ϼ�Ϊ+1�ۣ�![]() ��3����λ����ɣ����ݻ����ﻯ�ϼ�Ϊ0��֪��V��+3�ۣ�
��3����λ����ɣ����ݻ����ﻯ�ϼ�Ϊ0��֪��V��+3�ۣ�
��2����a�����չ�����VԪ�ر��������ڸ��������б����������������Ч�ʣ���a�������⣻
b�������������ɶȺ����Կ���߹��巴Ӧ��Ч���Լ���Ӧ���ʣ����������Ч�ʣ���b�������⣻
c���ֶο��¿ɷ�ֹ���ȵ��¹����飬���������Ч�ʣ���c�������⣻
d�����ϲ��ȹ��ߣ������ڷ�Ӧ�ij�ֽ��У�����轵���ϲ�ĺ�ȣ���d���������⣻
�ʴ�Ϊ��a��b��c��
�ڱ��չ�����V2O3ת��ΪCa(VO3)2��VԪ�ػ��ϼ����ߣ���˿�����O2�μӷ�Ӧ���䷴Ӧ����ʽΪ��![]() ��
��
��3�����ɱ����֪����Ҫ�Ʊ�����һ����״K3V2(PO4)3�����ߣ���������Ϊ6.0g��
�ڲ����ںϳɹ���������ԭ�����ɱ����֪�����ᾧ���ʹ������ͬ�������ߵ���òҲ�ᷢ���ñ䣬���ѡ�ò��ᾧ��������������Ƶ�ԭ��Ϊ�������ںϳ���״̼����K2V2(PO4)3�����ߵĹ����в�������ԭ����Ӱ������ò��
��4������ֻ��![]() �IJ���Ϊ��ԭ�������ᱻ����ΪCO2������
�IJ���Ϊ��ԭ�������ᱻ����ΪCO2������![]() ��ԭ��VO2+��
��ԭ��VO2+��![]() �IJ�����
�IJ�����![]() ����ʽ���ڣ�����������ԭת�Ƶ����غ㡢����غ��Լ�ԭ���غ��֪�����ӷ�Ӧ����ʽΪ��
����ʽ���ڣ�����������ԭת�Ƶ����غ㡢����غ��Լ�ԭ���غ��֪�����ӷ�Ӧ����ʽΪ��![]() ��
��
��5��K3V2(PO4)3��V��+3�ۣ����ױ�������������������������������������ֹK3V2(PO4)3��������
��6����ʯú�з�Ԫ�ص���������Ϊ![]() ����������������VԪ�������غ�ɵã�
����������������VԪ�������غ�ɵã�
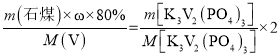 ��
��![]() =
=![]() �����
�����![]() =0.0204����ʯú�з�Ԫ�ص���������Ϊ2.04%��
=0.0204����ʯú�з�Ԫ�ص���������Ϊ2.04%��

 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�