题目内容
【题目】(1)铜是生命必需的元素,也是人类广泛使用的金属。现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2SFe2S3)的方法获得铜。火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2![]() Cu2S+3SO2+2FeO,反应中被还原的元素有_________,每转移0.6mol电子,有_________mol硫被氧化。
Cu2S+3SO2+2FeO,反应中被还原的元素有_________,每转移0.6mol电子,有_________mol硫被氧化。
(2)产物中的SO2是一种大气污染物,可选用下列试剂中的_________吸收(选填编号)。
a.浓H2SO4b.稀HNO3c.NaOH溶液d.CaCl2
(3)Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为:____________________________________。
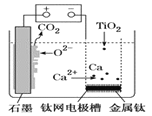
(4)某同学通过电化学原理实现了如下转化:Cu+2H+→Cu2++H2↑,则H2在_________极获得(填写电极名称)。
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释______。
(6)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物_________(填写化学式)。
【答案】Fe,O 0.1 c 2Cu2O+10HNO3→4Cu(NO3)2+NO↑+NO2↑+5H2O 阴 Fe(OH)3 因为Fe3+会水解产生较多的H+:Fe3++3H2O![]() Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀 HCl,H2SO4
Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀 HCl,H2SO4
【解析】
2CuFeS2+4O2![]() Cu2S+3SO2+2FeO中,铁和氧元素的化合价降低,硫元素的化合价升高,利用化合价变化计算被氧化的硫;铜元素的化合价为+1,升高为+2价,气体产生为一氧化氮和二氧化氮的混合物,得到电子数为4,氧化亚铜失去电子数为2,结合电子守恒及原子守恒分析。
Cu2S+3SO2+2FeO中,铁和氧元素的化合价降低,硫元素的化合价升高,利用化合价变化计算被氧化的硫;铜元素的化合价为+1,升高为+2价,气体产生为一氧化氮和二氧化氮的混合物,得到电子数为4,氧化亚铜失去电子数为2,结合电子守恒及原子守恒分析。
(1) 2CuFeS2+4O2![]() Cu2S+3SO2+2FeO,CuFeS2可表示为Cu2SFe2S3,即铜的化合价为+1,铁的化合价为+3,硫的化合价为-2,氧气作为氧化剂,反应中被还原的元素有铁和氧元素,每转移0.6mol电子,有0.1mol硫被氧化。
Cu2S+3SO2+2FeO,CuFeS2可表示为Cu2SFe2S3,即铜的化合价为+1,铁的化合价为+3,硫的化合价为-2,氧气作为氧化剂,反应中被还原的元素有铁和氧元素,每转移0.6mol电子,有0.1mol硫被氧化。
(2) a.浓H2SO4具有吸水性,不吸收二氧化硫,a错误;
b.稀HNO3具有氧化性,能与二氧化硫反应,但产物均有毒性,b错误;
c.NaOH溶液显碱性,能大量吸收二氧化硫,c正确;
d.CaCl2与二氧化硫不反应,d错误。
答案为C。
(3根据描述,发生反应的化学方程式为:2Cu2O+10HNO3=4Cu(NO3)2+NO↑+NO2↑+5H2O。
(4)某同学通过电化学原理实现了如下转化:Cu+2H+→Cu2++H2↑,氢离子得电子发生还原反应,属于阴极,则H2在阴极获得。
(5)向氯化铜和氯化铁的混合溶液中为酸性,加入氧化铜粉末后,氧化铜与溶液中的氢离子反应,促使铁离子的水解正向移动,产生氢氧化铁沉淀。详细解释为:因为Fe3+会水解产生较多的H+:Fe3++3H2O![]() Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀。
Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀。
(6)将SO2气体通入CuCl2溶液中,二氧化硫具有还原性,生成CuCl沉淀,铜化合价降低,故硫的化合价升高,产物还有HCl,H2SO4。