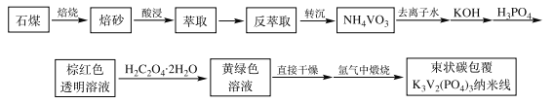
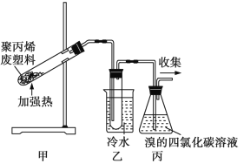
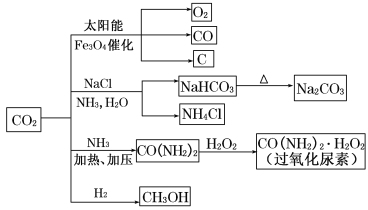
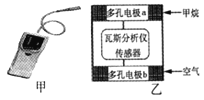
题目内容
【题目】铁—末端亚胺基物种被认为是铁催化的烯烃氮杂环丙烷化、C—H键胺化反应以及铁促进的由氮气分子到含氮化合物的转化反应中的关键中间体。对这类活性金属配合物的合成、谱学表征和反应性质的研究一直是化学家们关注的重点。我国科学家成功实现了首例两配位的二价铁—末端亚胺基配合物的合成。回答下列有关问题。
(1)Fe2+的价电子排布式___。
(2)1molNH4BF4(氟硼酸铵)中含有的配位键数是___。
(3)pH=6时,EDTA可滴定溶液中Fe2+的含量,EDTA的结构如图所示。
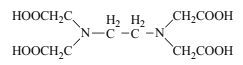
①结构中电负性最大的元素是___,其中C、N原子的杂化形式分别为___、___。
②EDTA可与多种金属阳离子形成稳定配合物的原因是___。
(4)我国科学家近年制备了热动力学稳定的氦-钠化合物,其晶胞结构如图所示。
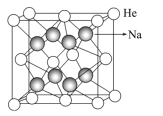
①该化合物的化学式为___。
②其晶胞参数为a=395pm,晶体密度为___g/cm3(NA表示阿伏加德罗常数数值,列出计算式即可)
【答案】3d6 2NA O sp2、sp3 sp3 含有多个配位原子,可与金属离子形成配位键 Na2He 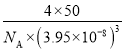
【解析】
(1)基态Fe的价电子排布式为:3d64s2,因此Fe2+的价电子排布式为3d6;
(2)![]() 与
与![]() 之间通过离子键组成化合物NH4BF4,
之间通过离子键组成化合物NH4BF4,![]() 中有1个H原子与N原子之间化学键为配位键,
中有1个H原子与N原子之间化学键为配位键,![]() 中有1个F原子与B原子之间化学键为配位键,因此1molNH4BF4中含有的配位键数是2NA;
中有1个F原子与B原子之间化学键为配位键,因此1molNH4BF4中含有的配位键数是2NA;
(3)①EDTA中含有H、C、N、O元素,C、N、O为同周期元素,从左至右电负性逐渐增大,因此电负性最大的元素是O;C、N原子周围全是单键的原子采取sp3杂化,-COOH中C原子采取sp2杂化;
②EDTA中N原子中含有1对孤对电子对,且存在多个N原子,因此可与金属离子形成配位键,故答案为:含有多个配位原子,可与金属离子形成配位键;
(4)①该晶胞中He原子分别位于棱角、面心,Na原子位于晶胞内部,因此1个晶胞中含有He原子数为:![]() ,Na原子数为:8,N(He):N(Na)=4:8=1:2,故该化合物的化学式为:Na2He;
,Na原子数为:8,N(He):N(Na)=4:8=1:2,故该化合物的化学式为:Na2He;
②该晶胞的体积![]() ,晶胞质量
,晶胞质量![]() ,故该晶胞密度
,故该晶胞密度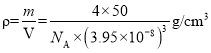 。
。