题目内容
【题目】用盐酸标准液来滴定NaOH待测液,下列操作可能会使测定结果偏低的是
A. 酸式滴定管只用水洗
B. 锥形瓶只用水洗
C. 使用甲基橙做指示剂
D. 第一次观察酸式滴定管的刻度时仰视
【答案】D
【解析】
根据c(待测)=![]() ,分析不当操作对V(标准)的影响,以此判断浓度的误差。
,分析不当操作对V(标准)的影响,以此判断浓度的误差。
A、酸式滴定管只用水洗,注入标准溶液盐酸后,标准液的浓度偏小,造成V(标)偏大,根据c(待测)![]() ,则c(待测)偏大,故A错误;
,则c(待测)偏大,故A错误;
B、锥形瓶只用水洗,待测液的物质的量无影响,V(标)无影响,根据c(待测)=![]() ,则c(待测)不变,故B错误;
,则c(待测)不变,故B错误;
C、使用甲基橙做指示剂,甲基橙在酸性范围内变色,造成V(标)偏大,根据c(待测)=![]() ,则c(待测)偏大,故C错误;
,则c(待测)偏大,故C错误;
D、若第一次观察酸式滴定管的刻度时仰视,结束后观察酸式滴定管的刻度时平视,造成V(标)偏小,由c(待测)=![]() 可以知道,c(待测)偏小,所以D选项是正确的。
可以知道,c(待测)偏小,所以D选项是正确的。
所以D选项是正确的。

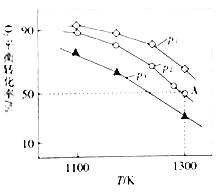
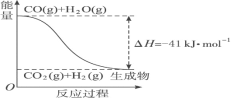
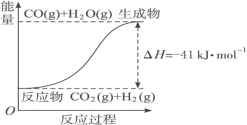
【题目】(1)“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g)+H2O(g)![]() CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | CO2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 650 | 2 | 1 | A | B | t |
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为_________
②A=_________
③平衡常数:K(900℃)_________K(650℃)(填“>”、“<”或“=”).
(2)温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是__________。
(3)下列描述中能说明上述反应已达平衡的是___________________
a.v正(CO)=v逆(H2) b.气体的密度不随时间而变化
c.H2和CO2的比例保持不变 d.气体的压强不再发生变化
(4)C、H、O、N元素中,写出两两组合(不能重复)形成的非极性分子的电子式_________,极性分子的电子式_________。这四种元素形成的化合物_________(填“一定是”、“一定不是”、“不一定是”)离子化合物。