题目内容
【题目】锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点﹣36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.
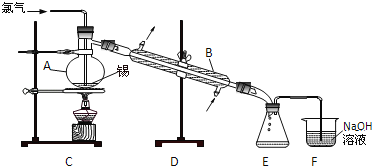
完成下列填空:
(1)仪器A的名称__; 仪器B的名称__.
(2)实验室制得的氯气中含HCl和水蒸气,须净化后再通入液态锡中反应,除去HCl的原因可能是__;除去水的原因是__.
(3)当锡熔化后,通入氯气开始反应,即可停止加热,其原因是__.若反应中用去锡粉11.9g,反应后在锥形瓶中收集到23.8g SnCl4,则SnCl4的产率为__.
(4)SnCl4遇水强烈水解的产物之一是白色的固态二氧化锡.若将SnCl4少许暴露于潮湿空气中,预期可看到的现象是__.
(5)已知还原性Sn2+>I﹣,SnCl2也易水解生成难溶的Sn(OH)Cl.如何检验制得的SnCl4样品中是否混有少量的SnCl2?__.
【答案】蒸馏烧瓶 冷凝管 Sn可能与HCl反应生成SnCl2 防止SnCl4水解 Sn和Cl2 反应放出大量的热 91.2% 空气中有白烟 取样品少许,溶于稀盐酸中,加2滴碘的淀粉溶液,振荡,若紫色褪去,说明SnCl4混有少量的SnCl2,否则SnCl4纯净
【解析】
装置A有支管,因此是蒸馏烧瓶,氯气进入烧瓶与锡反应得到![]() ,加热后
,加热后![]() 挥发,进入装置B冷凝管中,注意冷凝水的方向是下进上出,冷却后的
挥发,进入装置B冷凝管中,注意冷凝水的方向是下进上出,冷却后的![]() 变为液体,经牛角管进入锥形瓶E中收集,而F中的烧碱溶液可以吸收过量的氯气,据此来分析作答。
变为液体,经牛角管进入锥形瓶E中收集,而F中的烧碱溶液可以吸收过量的氯气,据此来分析作答。
(1)装置A是蒸馏烧瓶,装置B是冷凝管;
(2)锡在金属活动顺序表中位于氢之前,因此金属锡会和![]() 反应得到无用的
反应得到无用的![]() ,而除去水蒸气是为了防止
,而除去水蒸气是为了防止![]() 水解;
水解;
(3)此反应过程会放出大量的热,因此此时我们可以停止加热,靠反应放出的热将![]() 持续蒸出;根据
持续蒸出;根据![]() 算出锡的物质的量,代入
算出锡的物质的量,代入![]() 的摩尔质量算出理论上能得到26.1克
的摩尔质量算出理论上能得到26.1克![]() ,则产率为
,则产率为![]() ;
;
(4)水解产生白色的固态二氧化锡,应该能在空气中看到一些白烟;
(5)根据题目给出的信息,若溶液中存在![]() ,则可以将
,则可以将![]() 还原为
还原为![]() ,因此我们取样品少许,溶于稀盐酸中,加2滴碘的淀粉溶液,振荡,若紫色褪去,说明SnCl4混有少量的SnCl2,否则SnCl4纯净。
,因此我们取样品少许,溶于稀盐酸中,加2滴碘的淀粉溶液,振荡,若紫色褪去,说明SnCl4混有少量的SnCl2,否则SnCl4纯净。