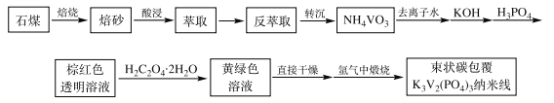
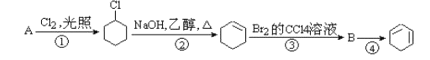
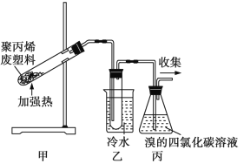
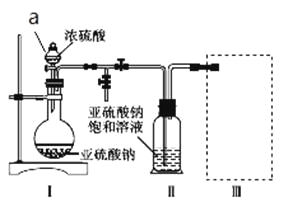
题目内容
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(![]() ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )
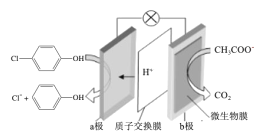
A.b为电池的正极,发生还原反应
B.电流从b极经导线、小灯泡流向a极
C.当外电路中有0.2mole-转移时,a极区增加的H+的个数为0.2NA
D.a极的电极反应式为:![]() +2e-+H+=Cl-+
+2e-+H+=Cl-+![]()
【答案】D
【解析】
原电池中阳离子移向正极,根据原电池中氢离子的移动方向可知a为正极,正极有氢离子参与反应,电极反应式为![]() +2e-+H+═
+2e-+H+═![]() +Cl-,电流从正极经导线流向负极,以此解答该题。
+Cl-,电流从正极经导线流向负极,以此解答该题。
A.a为正极,正极有氢离子参与反应,电极反应式为![]() +2e-+H+═
+2e-+H+═![]() +Cl-,发生还原反应,b为负极,物质在该极发生氧化反应,故A错误;
+Cl-,发生还原反应,b为负极,物质在该极发生氧化反应,故A错误;
B.由上述分析可知,电流从正极a沿导线流向负极b,故B错误;
C.据电荷守恒,当外电路中有0.2mole转移时,通过质子交换膜的H+的个数为0.2NA,而发生![]() +2e-+H+═
+2e-+H+═![]() +Cl-,则a极区增加的H+的个数为0.1NA,故C错误;
+Cl-,则a极区增加的H+的个数为0.1NA,故C错误;
D.a为正极,正极有氢离子参与反应,电极反应式为:![]() +2e-+H+═
+2e-+H+═![]() +Cl-,故D正确;
+Cl-,故D正确;
故答案为:D。

 阅读快车系列答案
阅读快车系列答案【题目】烟气(主要污染物SO2、NOX)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中的SO2、NOx 的含量。
(1) O3氧化烟气中SO2、NOx 的主要反应的热化学方程式为: NO(g)+O3(g)![]() NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)
NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)![]() 3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)
3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)![]() 2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
(2)T℃时,利用测压法在刚性反应器中,投入一定量的NO2发生反应3NO2(g)![]() 3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
①若降低反应温度,则平衡后体系压强 p______24.00 MPa(填“>”、“<”或“=”),原因是____________。
②15min 时,反应物的转化率 α=______。
③T℃时反应3NO2(g)![]() 3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
(3)T℃时,在体积为2L的密闭刚性容器中,投入2 mol NO2发生反应2NO2(g)![]() 2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):
2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):

①在体积不变的刚性容器中,投入固定量的NO2发生反应,要提高NO2转化率,可采取的措施是______________、___________。
②由图中数据,求出该反应的平衡常数为_________。
③计算A 点处v正/v逆=_________________________(保留1位小数)。
【题目】(1)“一氧化碳变换”是合成氨原料气生产中的重要环节,其反应方程式为:CO(g)+H2O(g)![]() CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | CO2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 650 | 2 | 1 | A | B | t |
①实验1中从反应开始到达到平衡,以H2的浓度变化表示的反应速率为_________
②A=_________
③平衡常数:K(900℃)_________K(650℃)(填“>”、“<”或“=”).
(2)温度是一氧化碳变换中最重要的工艺条件,实际生产过程中将温度控制在400℃左右,可能的原因是__________。
(3)下列描述中能说明上述反应已达平衡的是___________________
a.v正(CO)=v逆(H2) b.气体的密度不随时间而变化
c.H2和CO2的比例保持不变 d.气体的压强不再发生变化
(4)C、H、O、N元素中,写出两两组合(不能重复)形成的非极性分子的电子式_________,极性分子的电子式_________。这四种元素形成的化合物_________(填“一定是”、“一定不是”、“不一定是”)离子化合物。