题目内容
4.等温等压下,有质子数相等的CO、N2、C2H2三种气体,下列叙述中正确的是( )| A. | 体积之比13:13:14 | B. | 密度之比14:14:13 | ||
| C. | 质量之比1:1:1 | D. | 原子数之比1:1:1 |
分析 CO、N2、C2H2三种气体涉及的元素有C、H、O、N质子数分别为6、1、8、7,所以三种气体的分子的质子数分别为:14、14、14,质子数相等的CO、N2、C2H2三种气体,物质的量相等.
A.等温等压下,体积之比与物质的量成正比;
B.等温等压下,气体摩尔体积相同,ρ=$\frac{m}{V}$=$\frac{nM}{n{V}_{m}}$=$\frac{M}{{v}_{m}}$分析判断;
C.根据m=nM分析解答;
D.1分子CO、N2、C2H2分别含原子数为:2、2、4.
解答 解:A.三种气体的分子的质子数分别为:14、14、14,质子数相等的CO、N2、C2H2三种气体,物质的量相等,等温等压下,体积之比与物质的量成正比,所以三者体积之比1:1:1,故A错误;
B.CO、N2、C2H2摩尔质量分别为28g/mol、28g/mol、26g/mol,等温等压下,气体摩尔体积相同,根据ρ=$\frac{m}{V}$=$\frac{nM}{n{V}_{m}}$=$\frac{M}{{v}_{m}}$知,密度与摩尔质量成正比,则密度之比为28:28:26=14:14:13,故B正确;
C.三种气体的分子的质子数分别为:14、14、14,质子数相等的CO、N2、C2H2三种气体,物质的量相等,CO、N2、C2H2摩尔质量分别为28g/mol、28g/mol、26g/mol,根据m=nM知:质量之比与摩尔质量成正比为28:28:26=14:14:13,故C错误;
D.三种气体的分子的质子数分别为:14、14、14,质子数相等的CO、N2、C2H2三种气体,物质的量相等,1分子CO、N2、C2H2分别含原子数为:2、2、4,所以三种气体原子数之比:1:1:2,故D错误;
故选B.
点评 本题考查以物质的量为中心的计算,涉及阿伏伽德罗定律的应用,题目难度不大,侧重于公式的联合应用.

| A. | 常温下,0.05mol•L1Fe2(SO4)3溶液中含Fe3+数目小于0.1NA | |
| B. | 30g甲醛中含4NA对电子 | |
| C. | 7.8g过氧化钠中含有0.1NA个阴离子 | |
| D. | 标准状况下,22.4L乙烷含有的分子数为NA |
| A. | 两溶液体积相同,酸是多元强酸 | |
| B. | 两溶液体积相同,酸是弱酸 | |
| C. | 酸是强酸,且酸溶液的浓度是碱溶液浓度的3倍以上 | |
| D. | 酸是强酸,且酸溶液的体积是碱溶液体积的3倍以上 |
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
| A. | 该实验表明SO2有漂白性 | B. | 白色沉淀为BaSO3 | ||
| C. | 该实验表明FeCl3有还原性 | D. | 反应后溶液酸性增强 |
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| B. | Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+═SO4 2-+S↓+H2O | |
| C. | 10 mL 0.1 mol/L FeI2溶液与标况下0.224L Cl2:Fe2++Cl2=2Cl-+2Fe3+ | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O |
| A. | 某温度下,任何电解质的稀溶液中,pC(H+)+pC(OH-)=14 | |
| B. | 0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大 | |
| C. | 0.01mol/L的BaCl2 溶液中,pC(Cl-)=2pC(Ba2+) | |
| D. | 用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小 |
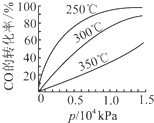 强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
 HClO+H++Cl-、HClO
HClO+H++Cl-、HClO H++ClO-、Cl2(g)
H++ClO-、Cl2(g) Cl2(aq).
Cl2(aq).