题目内容
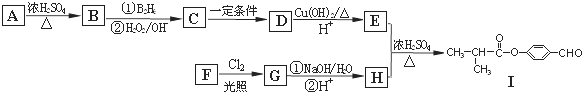
19.呋喃酚是合成农药的重要中间体,其合成路线如下: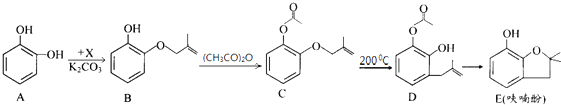
(1)A物质核磁共振氢谱共有3个峰,B→C的反应类型是取代反应.
(2)已知x的分子式为C4H7C1,写出A→B的化学方程式:
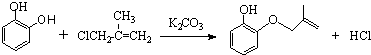 .
.(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y的名称(系统命名)是4-氯-1-丁烯.
(4)下列有关化合物C、D的说法正确的是①③④.
①可用氯化铁溶液鉴别C和D
②C和D含有的官能团完全相同
③C和D互为同分异构体
④C和D均能使溴水褪色
(5)E的同分异构体很多,写出一种符合下列条件的芳香族同分异构体的结构简式:
 .
.①环上的一氯代物只有一种 ②含有酯基 ③能发生银镜反应.
分析 (1)分子中有几种化学环境不同的氢原子,其核磁共振氢谱具有几组吸收峰;对比B、C的结构可知,B中酚-OH上的H被取代;
(2)A→B发生取代反应,结合B的结构简式可知x的结构为ClCH2C(CH3)=CH2;
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y为ClCH2CH2CH=CH2;
(4)C、D中均含-COOC-、双键,但D中含酚-OH,以此分析性质;
(5)E的同分异构体符合:①苯环上的一氯代物只有一种,则苯环上只有1种H,②含有酯基(-COOC-),③能发生银镜反应,含-CHO,则分子中应含3个甲基和1个-HCOO-,以此来解答.
解答 解:(1)A分子为对称结构,分子中含有3种氢原子,其核磁共振氢谱具有3组吸收峰;对比B、C的结构可知,B中酚-OH上的H被取代,B→C的反应属于取代反应,
故答案为:3;取代反应;
(2)A→B发生取代反应,结合B的结构简式可知x的结构为ClCH2C(CH3)=CH2,A→B的化学方程式为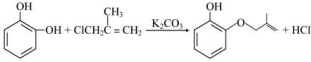 ,
,
故答案为: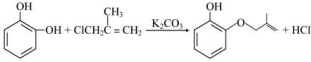 ;
;
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y为ClCH2CH2CH=CH2,名称为4-氯-1-丁烯,
故答案为:4-氯-1-丁烯;
(4)C、D中均含-COOC-、双键,但D中含酚-OH,则
①D与氯化铁发生显色反应,则可用氯化铁溶液鉴别C和D,故①正确;
②C、D含有的官能团不完全相同,故②错误;
③C、D的分子式相同,但结构不同,互为同分异构体,故③正确;
④均含双键,则C、D均能使溴水褪色,故④正确;
故答案为:①③④;
(5)E的同分异构体符合:①苯环上的一氯代物只有一种,则苯环上只有1种H,②含有酯基(-COOC-),③能发生银镜反应,含-CHO,则分子中应含3个甲基和1个-HCOO-,符合条件的芳香族同分异构体的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的合成、有机物结构与性质、同分异构体书写等,注意根据合成流程中的反应、官能团变化等为解答的关键,侧重分析与应用能力的考查,题目难度中等.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案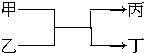 若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )
若甲、丙为短周期、同一主族元素形成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如图所示的转化关系,则满足条件的甲和丙可以为( )①钠和氢气 ②氟气和氧气 ③碳和硅 ④氯气和溴.
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H2=-242kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g)
④2C(s)+H2(g)=C2H2(g)△H4
下列正确的是( )
| A. | 反应①放出197kJ的热量,转移4mol电子 | |
| B. | 反应②可知1mol液态水分解所放出的热量为242kJ | |
| C. | 反应③表示C2H2燃烧热的热化学方程式 | |
| D. | △H4=2△H1+△H2-$\frac{1}{2}$△H3 |
| A. | 标准状况下11.2L乙烯和丙烯的混合气体中含C-H键的数目为2NA | |
| B. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| C. | 0.5mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| D. | 含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
| B | 浓硝酸 | Na2CO3 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 浓盐酸 | KMnO4 | FeBr2(足量) | 氧化性:Cl2>Br2 | |
| D | 浓硫酸 | 蔗糖 | 溴水 | 浓硝酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
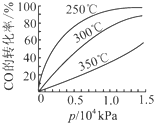 强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
 .
. .E与H反应生成I的方程式为
.E与H反应生成I的方程式为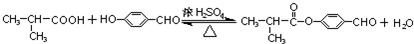 .
. HClO+H++Cl-、HClO
HClO+H++Cl-、HClO H++ClO-、Cl2(g)
H++ClO-、Cl2(g) Cl2(aq).
Cl2(aq).