题目内容
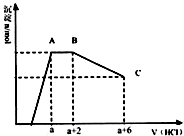
18.如图所示,电流计G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.则A、B、C为( )
| A. | A是Zn,B是Cu,C是稀硫酸 | B. | A是Cu,B是Zn,C是稀硫酸 | ||
| C. | A是Fe,B是Ag,C是稀AgNO3溶液 | D. | A是Ag,B是Fe,C是稀AgNO3溶液 |
分析 原电池中负极的活泼性大于正极的活泼性,负极上金属失电子变成离子进入溶液,质量减少,正极上得电子发生还原反应,正极上析出物质,若析出的物质是金属,则正极质量增加,据此分析.
解答 解:该原电池中,A极逐渐变粗,B极逐渐变细,所以B作负极,A作正极,B的活泼性大于A的活泼性,所以排除AC选项;
A极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,D选项析出金属,所以D符合题意.
故选D.
点评 本题考查了原电池原理,难度不大,明确正负极的判断方法,注意不能仅根据金属的活泼性判断正负极,要根据发生反应的反应类型判断正负极,如:Mg、Al、NaOH溶液构成的原电池,铝作负极,镁作正极.

练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
6.在一定条件下发生如下反应:2KClO3+I2=2KIO3+Cl2,则下列推断正确的是( )
| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂为I2 | |
| C. | 该反应中还原剂为KClO3 | |
| D. | 该反应中KClO3被还原为Cl2,I2被氧化为KIO3 |
13. 6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
(1)Y在周期表中的位置是第二周期ⅥA族.
(2)X、Y、Z三种元素的原子半径由大到小的顺序是r(N)>r(O)>r(F).
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(4)X的含10个电子的气态氢化物甲是一种重要的化工原料.甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应式是N2H4-4e-+4OH-═N2+4H2O.
(5)工业上用如图所示装置电解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂丙.该反应的离子方程式是Cl-+H2O $\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑.丙的电子式 .
.
(6)洁厕灵的主要成分是HCl.下列关于卤化氢的性质比较中错误的是AC
A.酸性:HF>HCl>HBr>HI B.键能:H-F>H-Cl>H-Br>H-I
C.沸点:HF<HCl<HBr<HI D.还原性:HF<HCl<HBr<HI.
 6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:| X | Y | Z | |
| W | M | Q |
(2)X、Y、Z三种元素的原子半径由大到小的顺序是r(N)>r(O)>r(F).
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(4)X的含10个电子的气态氢化物甲是一种重要的化工原料.甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应式是N2H4-4e-+4OH-═N2+4H2O.
(5)工业上用如图所示装置电解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂丙.该反应的离子方程式是Cl-+H2O $\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑.丙的电子式
 .
.(6)洁厕灵的主要成分是HCl.下列关于卤化氢的性质比较中错误的是AC
A.酸性:HF>HCl>HBr>HI B.键能:H-F>H-Cl>H-Br>H-I
C.沸点:HF<HCl<HBr<HI D.还原性:HF<HCl<HBr<HI.
3. 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )| A. | 原溶液肯定含有OH-,CO32-,AlO2-,SiO32- | |
| B. | K+和Na+至少含有其中一种 | |
| C. | n(CO32-):n(AlO2-)=3:2 | |
| D. | a值肯定大于$\frac{4}{3}$ |
7. 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )| A. | 如图是滴定盐酸的曲线 | |
| B. | 当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) | |
| C. | B点时,反应消耗溶液体积:V(NaOH)<V(HA) | |
| D. | E点时溶液中离子浓度为c(Na+)=c(A-) |
8.同温同压下,两种气体的体积如果不相同,其主要原因是( )
| A. | 气体的分子大小不同 | B. | 气体分子间的平均距离不同 | ||
| C. | 气体的性质不同 | D. | 气体的物质的量不同 |
 将反应2Fe3++Cu═2Fe2++Cu2+设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液.
将反应2Fe3++Cu═2Fe2++Cu2+设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液.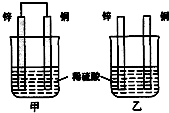 (1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.