题目内容
2. 将反应2Fe3++Cu═2Fe2++Cu2+设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液.
将反应2Fe3++Cu═2Fe2++Cu2+设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液.(1)石墨是电池的正极,X应选CuSO4溶液,Y应选FeCl3溶液.
(2)正极上的电极反应式是2Fe3++2e-═2Fe2+.原电池工作时,盐桥中的阴离子不断进入X溶液.
分析 根据原电池工作原理结合总反应方程式,还原剂铜作负极发生氧化反应,石墨作正极发生还原反应,氧化剂的溶液作电解质溶液,阴离子移向阴极,据此分析解答;
解答 解:(1)2Fe3++Cu═2Fe2++Cu2+,该反应中,铜失电子生成二价铜离子进入溶液,所以铜为负极,X为CuSO4溶液,石墨为正极,反应为2Fe3++2e-═2Fe2+,所以Y为FeCl3溶液,
故答案为:正;CuSO4;FeCl3;
(2)石墨为正极,反应为2Fe3++2e-═2Fe2+,X溶液为负极,所以盐桥中的阴离子不断进入X溶液,故答案为:2Fe3++2e-═2Fe2+;阴.
点评 本题考查了原电池的原理的分析应用,关键是负极材料和电解质溶液的成分,一般来说,还原剂作负极,氧化剂的溶液作电解质溶液,难度不大.

练习册系列答案
相关题目
10.下列不同条件下发生化学反应:A+B═C+D,反应速率由大到小的顺序正确的一组是( )
①常温下,20mL溶液中含A和B各0.001mol;
②常温下,100mL溶液中含A和B各0.01mol;
③常温下,向10mL含A和B各0.0005mol的溶液中再加入蒸馏水30ml;
④常温下,100mL溶液中含A 0.01mol和B 0.005mol.
①常温下,20mL溶液中含A和B各0.001mol;
②常温下,100mL溶液中含A和B各0.01mol;
③常温下,向10mL含A和B各0.0005mol的溶液中再加入蒸馏水30ml;
④常温下,100mL溶液中含A 0.01mol和B 0.005mol.
| A. | ①②③④ | B. | ④③②① | C. | ②④①③ | D. | ②①④③ |
14.常温下,下列叙述正确的是( )
| A. | pH=5.6的由CH3COOH与CH3COONa组成的混合溶液中:c(Na+)>c(CH3C00-) | |
| B. | 将PH=a的醋酸稀释为pH=a+1的过程中,C(OH-)不断增大 | |
| C. | 等体积pH=a的盐酸与pH=b的氨水溶液恰好中和时,a+b=14 | |
| D. | 浓度均为0.1 mol•L-1的CH3COOH溶液和氨水等体积混合后:c(CH3COO-)+c(H+)=c(NH4+)+c(OH-) |
11.下列有关过氧化钠的叙述中,不正确的是( )
| A. | 过氧化钠为淡黄色固体 | |
| B. | 过氧化钠与水反应是放热反应 | |
| C. | 过氧化钠可用于呼吸面具中作为氧气的来源 | |
| D. | 过氧化钠与二氧化碳反应是置换反应 |
18.如图所示,电流计G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.则A、B、C为( )

| A. | A是Zn,B是Cu,C是稀硫酸 | B. | A是Cu,B是Zn,C是稀硫酸 | ||
| C. | A是Fe,B是Ag,C是稀AgNO3溶液 | D. | A是Ag,B是Fe,C是稀AgNO3溶液 |

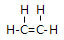 ;由元素④和元素②形成的化合物的电子式为
;由元素④和元素②形成的化合物的电子式为 ;元素⑦的原子结构示意图为
;元素⑦的原子结构示意图为 .
. (若有配位键,用箭号表示)
(若有配位键,用箭号表示)

 b.
b.