题目内容
3.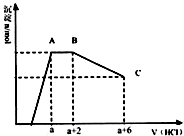 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )| A. | 原溶液肯定含有OH-,CO32-,AlO2-,SiO32- | |
| B. | K+和Na+至少含有其中一种 | |
| C. | n(CO32-):n(AlO2-)=3:2 | |
| D. | a值肯定大于$\frac{4}{3}$ |
分析 依据图象分析可知,开始无沉淀生成说明加入的盐酸和溶液中的OH-反应,则与氢氧根离子反应的离子不能共存:Fe3+、Mg2+、Al3+;然后反应生成沉淀逐渐增大,说明是AlO2-和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中至少含有K+、Na+离子中的一种.
解答 解:由图象可知,开始加入HCl时无沉淀生成,说明加入的HCl与溶液中OH-的反应,则溶液中一定不会存在与氢氧根离子发生反应的离子:Fe3+、Mg2+、Al3+;之后开始生成沉淀且反应生成沉淀逐渐增大,说明溶液中存在AlO2-、SiO32-,继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,碳酸根离子反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中至少含有K+、Na+离子中的一种离子,
A、依据判断原溶液中一定含有的离子是:OH-、SiO32-、AlO2-、CO32-,故A正确;
B、依据判断原溶液中一定含有的离子是:OH-、SiO32-、AlO2-、CO32-,至少含有K+、Na+离子中的一种离子,不能确定是否含有钠离子,故B正确;
C、依据图象可知和碳酸根离子反应的盐酸为2体积,CO32-+2H+=CO2↑+H2O 氢氧化铝溶解消耗的盐酸体积为4体积,Al(OH)3+3H+=Al3++3H2O;原溶液中含有CO32-与AlO2-的物质的量之比为3:4,故C错误;
D、根据图中信息,消耗4体积的盐酸将氢氧化铝完全溶解,根据AlO2-~Al(OH)3~3H+,所以,所以将偏铝酸根转化为沉淀消耗的盐酸是可以认为是$\frac{4}{3}$,但是硅酸根离子也会消耗盐酸形成硅酸沉淀,即a值肯定大于$\frac{4}{3}$,故D正确.
故选C.
点评 本题考查了离子检验的方法应用,图象分析判断是解题关键,硅酸根离子、偏铝酸根离子和酸反应生成沉淀,氢氧化铝是两性氢氧化物溶于强酸是解题关键.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | 绝热性 | B. | 绝缘性 | C. | 导热性 | D. | 熔点低 |
| A. | CH3CH2C≡CCH3 3-戊炔 | B. | CH(CH3)2CH(OH) CH3 2-甲基-3-丁醇 | ||
| C. | CH3CHClCH2CH3 2-氯丁烷 | D. | CH3CH=CHCH3 丁烯 |

| A. | A是Zn,B是Cu,C是稀硫酸 | B. | A是Cu,B是Zn,C是稀硫酸 | ||
| C. | A是Fe,B是Ag,C是稀AgNO3溶液 | D. | A是Ag,B是Fe,C是稀AgNO3溶液 |
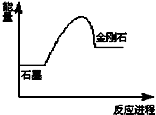
| A. | 该反应为放热反应 | B. | 金刚石比石墨稳定 | ||
| C. | 石墨比金刚石稳定 | D. | 该反应为氧化还原反应 |
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | CH2F2的电子式: | D. | 甲醛的结构式: |

(1)某小组拟研究放置己久的小苏打样品中纯碱的质量分数.限选试剂和仪器:NaHCO3样品、碱石灰、0.1mol/LHCl、0.1mol/LH2SO4、浓H2SO4、烧瓶、双孔塞、玻璃导管、胶管、广口瓶、干燥管.
①写出本实验小苏打样品与酸反应的全部化学方程式(两条)2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O,Na2CO3+H2SO4=Na2SO4+CO2↑+H2O.
②设计实验方案:实验中除称量样品质量外,还需测定生成CO2的质量.
③设计实验装置,完成下图装置示意图及标注.
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂质量,需记录的待测物理量和所拟定的数据;数据用字母表示).
| 物理量 | 样品质量/g | … | ||
| 实 验 | a | … |

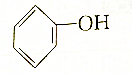 b.
b.
 A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示:请回答下列问题:
A、B、X、Y均为中学阶段的常见物质,它们之间的转化关系如图所示:请回答下列问题: