题目内容
10. (1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)═NaCl(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)═2H2O(1)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为H2+2OH--2e-=2H2O;正极反应为O2+4e-+2H2O=4OH-
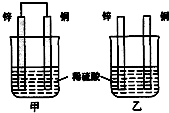
(3)将纯锌片和纯铜片按图方式插入100mL浓度均为1mol/L的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是BD.
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液中的H+均减小
②请写出图中构成原电池的负极电极反应式Zn-2e-=Zn2+.电池工作时,溶液中SO42-向负极移动,电池工作完成后,忽略溶液体积的变化,溶液中SO42-浓度不变(填“增大或减小或不变”),若导线上转移电子0.15mol,则溶液中剩余硫酸的物质的量为0.025mol.
分析 (1)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(2)氢氧燃料碱性电池中,负极上氢气失去电子,正极发生还原反应;
(3)①甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
②原电池负极的金属失电子发生氧化反应;阴离子向负极移动;硫酸根离子的物质的量不变,而忽略溶液体积的变化,所以硫酸根离子的浓度不变,若导线上转移电子0.15mol,消耗$\frac{0.15}{2}$mol=0.075mol的硫酸,所以剩余硫酸的物质的量为0.1L×1mol/L-0.075mol=0.1mol-0.075mol=0.025mol.
解答 解:(1)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;
故答案为:C;
(2)以KOH溶液为电解质溶液,氢氧燃料碱性电池中,负极上氢气失去电子,负极反应为H2+2OH--2e-=2H2O,正极反应为:O2+4e-+2H2O=4OH-,
故答案为:H2+2OH--2e-=2H2O; O2+4e-+2H2O=4OH-;
(3)①甲装置是原电池,发生电化学腐蚀,乙装置发生化学腐蚀.
A、甲是化学能转变为电能的装置,乙不是,故A错误;
B、乙装置中铜片不反应,也没构成原电池的正极,所以铜片上没有明显变化,故B正确;
C、甲、乙中锌片质量都减少,故C错误;
D、两个烧杯中都产生氢气,氢离子浓度都降低,所以溶液的pH均增大,故D正确;
故选BD;
②构成原电池的负极是锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,阴离子向负极移动;硫酸根离子的物质的量不变,而忽略溶液体积的变化,所以硫酸根离子的浓度不变,若导线上转移电子0.15mol,消耗$\frac{0.15}{2}$mol=0.075mol的硫酸,所以剩余硫酸的物质的量为0.1L×1mol/L-0.075mol=0.1mol-0.075mol=0.025mol,故答案为:Zn-2e-=Zn2+;负;不变; 0.025mol.
点评 本题考查学生原电池的构成条件以及燃料电池的工作原理知识,属于综合知识的考查,难度不大.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | pH=5.6的由CH3COOH与CH3COONa组成的混合溶液中:c(Na+)>c(CH3C00-) | |
| B. | 将PH=a的醋酸稀释为pH=a+1的过程中,C(OH-)不断增大 | |
| C. | 等体积pH=a的盐酸与pH=b的氨水溶液恰好中和时,a+b=14 | |
| D. | 浓度均为0.1 mol•L-1的CH3COOH溶液和氨水等体积混合后:c(CH3COO-)+c(H+)=c(NH4+)+c(OH-) |

| A. | A是Zn,B是Cu,C是稀硫酸 | B. | A是Cu,B是Zn,C是稀硫酸 | ||
| C. | A是Fe,B是Ag,C是稀AgNO3溶液 | D. | A是Ag,B是Fe,C是稀AgNO3溶液 |
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | CH2F2的电子式: | D. | 甲醛的结构式: |
| A. | 碳纤维是一种新开发的材料,它属于合成有机高分子化合物 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| D. | 氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程为Cl2+2Br-=2Cl-+Br2.
(5)①的单质常用做工业上合成某种碱性气体,写出该碱性气体被氧气催化氧化的反应化学方程式4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O.
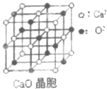 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,