题目内容
【题目】常温下,下列溶液中,有关微粒的物质的量浓度关系不正确的是
A.0.1mol/L的NaA溶液和0.1mol/L的HA溶液等体积混合pH=4.75,则溶液:c(HA)+c(H+)=c(OH-)+c(A-)
B.0.1mol·L-1(NH4)2Fe(SO4)2溶液:c(NH4+)+2c(Fe2+)+c(H+)=2c(SO42-)+c(OH-)
C.分别用pH=2和pH=3的CH3COOH溶液中和含等物质的量NaOH的溶液,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va<Vb
D.等物质的量浓度的①NH4Cl溶液②(NH4)2SO4溶液③NH4HSO4溶液④(NH4)2CO3溶液⑤NH4HCO3中NH4+浓度的大小关系是②>④>③>①>⑤
【答案】A
【解析】
A.溶液混合后,电荷守恒为:![]() ,物料守恒为:
,物料守恒为:![]() ,整理可得:
,整理可得:![]() ,故A符合题意;
,故A符合题意;
B.0.1mol·L-1(NH4)2Fe(SO4)2溶液电荷守恒为:![]() ,故B不符合题意;
,故B不符合题意;
C.pH=2和pH=3的CH3COOH,pH=2的醋酸大于pH=3的醋酸的10倍,中和等物质的量的NaOH,设pH为2的醋酸浓度为x,pH=3的醋酸浓度为y,则有Va×x=Vb×y,则![]() ,即Vb>10Va,故C不符合题意;
,即Vb>10Va,故C不符合题意;
D.①NH4Cl溶液中![]() 正常水解,②(NH4)2SO4溶液中
正常水解,②(NH4)2SO4溶液中![]() 正常水解,由化学式可知
正常水解,由化学式可知![]() 浓度大于①,③NH4HSO4溶液中
浓度大于①,③NH4HSO4溶液中![]() 水解受到抑制,因此
水解受到抑制,因此![]() 浓度大于①而小于②,④(NH4)2CO3溶液中
浓度大于①而小于②,④(NH4)2CO3溶液中![]() 水解受到促进作用,因此
水解受到促进作用,因此![]() 浓度小于②,由化学式可知,最终
浓度小于②,由化学式可知,最终![]() 浓度大于③,⑤NH4HCO3溶液中中
浓度大于③,⑤NH4HCO3溶液中中![]() 水解受到促进作用,因此
水解受到促进作用,因此![]() 浓度小于①,最终
浓度小于①,最终![]() 浓度的大小关系为:②>④>③>①>⑤,故D不符合题意;
浓度的大小关系为:②>④>③>①>⑤,故D不符合题意;
故答案为:A。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
已知化学键键能数据如表:
化学健 | C﹣H | C=O | H﹣H | C≡O(CO) | ||
键能(kJ/mol) | 413 | 745 | 436 | 1075 |
(1)①CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。则该反应的△H=_____________。
2CO(g)+2H2(g)。则该反应的△H=_____________。
②在恒容绝热条件下,一定能说明该反应已达平衡状态的是_____________。(填字母)
A.混合气体的密度不再变化B.混合气体的平均相对分子质量不再变化
C.容器内的温度不再变化D.v正(CH4)=2v逆(H2)
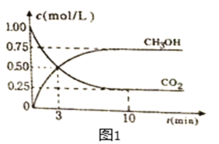
(2)利用CO2可制取甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
(3)下列措施能使![]() 增大的是________。
增大的是________。
A.降低温度
B.恒温恒容下,再充入2molCO2、6molH2
C.使用高效催化剂
D.恒温恒容充入He(g)使体系压强增大
(4)一种熔融碳酸盐燃料电池原理示意如图2。
①该电池的负极反应式为_____________
②电池工作时,CO32﹣向电极_____________移动(填A或者B)。