题目内容
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
已知化学键键能数据如表:
化学健 | C﹣H | C=O | H﹣H | C≡O(CO) | ||
键能(kJ/mol) | 413 | 745 | 436 | 1075 |
(1)①CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。则该反应的△H=_____________。
2CO(g)+2H2(g)。则该反应的△H=_____________。
②在恒容绝热条件下,一定能说明该反应已达平衡状态的是_____________。(填字母)
A.混合气体的密度不再变化B.混合气体的平均相对分子质量不再变化
C.容器内的温度不再变化D.v正(CH4)=2v逆(H2)
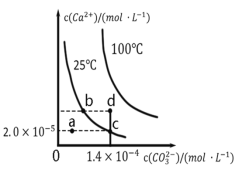
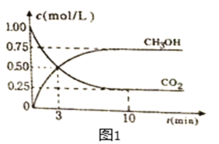
(2)利用CO2可制取甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
(3)下列措施能使![]() 增大的是________。
增大的是________。
A.降低温度
B.恒温恒容下,再充入2molCO2、6molH2
C.使用高效催化剂
D.恒温恒容充入He(g)使体系压强增大
(4)一种熔融碳酸盐燃料电池原理示意如图2。
①该电池的负极反应式为_____________
②电池工作时,CO32﹣向电极_____________移动(填A或者B)。

【答案】+120kJ/mol BC ![]() 5.33 AB
5.33 AB ![]() 、
、![]() A
A
【解析】
(1)①该反应△H=反应物键能之和-生成物键能之和=(4×413+745×2)kJ/mol-(2×1075+2×436) kJ/mol=+120 kJ/mol;
②A.该反应中所有物质均为气体,反应过程中气体总质量不变,容器体积不变,因此混合气体的密度始终不变,因此不能判断反应是否达到平衡状态,故A不符合题意;
B.反应过程中气体总质量不变,气体的物质的量发生变化,当气体的物质的量不变时,混合气体的平均相对分子质量不再变化,可说明反应处于平衡状态,故B符合题意;
C.反应过程中一定存在相应的能量交换,该装置为绝热装置,因此当容器内的温度不再变化时,反应一定处于平衡状态,故C符合题意;
D.当反应处于平衡状态时,2v正(CH4)=v逆(H2),故D不符合题意;
故答案为:BC;
(2)反应在第10min达到平衡状态,因此从开始至平衡过程中![]() ;达到平衡时,
;达到平衡时,![]() 、
、![]() 、
、![]() 、
、![]() ,平衡常数
,平衡常数![]() ;
;
(3)A.降低温度,平衡将正向移动,![]() 减小,
减小,![]() 增大,
增大,![]() 将增大,故A符合题意;
将增大,故A符合题意;
B.恒温恒容下,再充入2molCO2、6molH2,相当于增大压强,平衡正向移动,新平衡时,![]() 小于原平衡2倍,
小于原平衡2倍,![]() 大于原平衡2倍,
大于原平衡2倍,![]() 将增大,故B符合题意;
将增大,故B符合题意;
C.催化剂不改变化学平衡,因此不会改变![]() ,故C不符合题意;
,故C不符合题意;
D.充入He(g)后,各反应物的分压不变,平衡不移动,![]() 不变,故D不符合题意;
不变,故D不符合题意;
故答案为:AB;
(4)通入O2的一极为正极,因此电极B为正极,电极A为负极,
①负极上CO、H2发生氧化反应分别生成CO2、H2O,电极反应式为:![]() 、
、![]() ;
;
②电池工作时,阴离子由还原电极移向氧化电极,因此![]() 向电极A移动。
向电极A移动。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为_______________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为_______________________。
(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为___________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为_________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1539 | 183 |
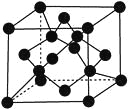
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为___________,
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子。