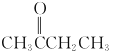题目内容
【题目】1-溴丁烷是无色透明液体,可用作制药、染料、功能性色素、香料等的原料,也可作半导体中间原料。其实验窒制备原理及流程如图:
KBr+H2SO4![]() HBr+KHSO4
HBr+KHSO4
C4H9OH+HBr![]() C4H9Br+H2O
C4H9Br+H2O

可能用到的有关数据及信息如下表:
名称 | 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解性 | 浓硫酸中溶解性 |
正丁醇 | 74 | 117.7 | 0.8098 | 微溶 | 能溶 |
1-溴丁烷 | 137 | 101.6 | 1.266 | 微溶 | 不溶 |
正丁醚 | 130 | 142 | 0.7689 | 不溶 | 反应成盐 |
回答下列问题:
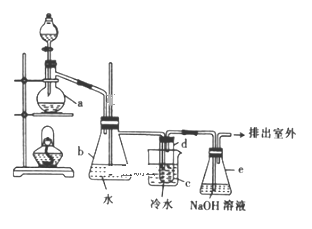
(1)操作Ⅰ是用如图所示实验装置,加热仪器A中的反应物制备1-溴丁烷(加热和夹持装置均略去)。

①仪器B的作用是_________。
②若浓硫酸太浓或加热A时温度过高,均会产生大量红棕色气体,原因是________(用化学方程式表示);该制备反应中产生的有机副产物除正丁醚外,还可能有_______(填结构简式)。
③图中装置有一处错误,请提出改进建议:__________。
(2)操作Ⅱ是用如图所示实验装置蒸出1-溴丁烷粗产品(加热和夹持装置均略去)。

①仪器D的名称是_______。
②判断1-溴丁烷是否蒸完的方法是_______。
(3)操作Ⅲ是将产品转移至分液漏斗中,依次经过水、浓硫酸、水、10mL 10%碳酸钠溶液、水五次洗涤并分液,目的是除去1-溴丁烷粗产品的各种杂质。
①浓硫酸的主要作用是_______。
②用10mL 10%碳酸钠溶液洗涤时必须的操作是_______。
(4)操作N将产品用无水CaCl2干燥后再蒸馏纯化。1-溴丁烷的产率为____ (近似取整)%。
【答案】冷凝回流 2HBr+H2SO4(浓)![]() SO2↑+Br2↑+2H2O CH2=CHCH2CH3 将仪器C中的导管换成漏斗,且漏斗边缘接近水面 尾接管 用盛有少量水的小试管,收集几滴管出液,若无油珠则已蒸完(或观察流出液是否由浑浊变为澄清、烧瓶中层油层是否完全消失或温度计显示温度发生改变等) 除去正丁醚及少量正丁醇 开启活塞放气 60
SO2↑+Br2↑+2H2O CH2=CHCH2CH3 将仪器C中的导管换成漏斗,且漏斗边缘接近水面 尾接管 用盛有少量水的小试管,收集几滴管出液,若无油珠则已蒸完(或观察流出液是否由浑浊变为澄清、烧瓶中层油层是否完全消失或温度计显示温度发生改变等) 除去正丁醚及少量正丁醇 开启活塞放气 60
【解析】
(1)①根据操作Ⅰ实验装置图,可知仪器B是冷凝管,在此装置中起到冷凝回流作用,故答案:冷凝回流;
②浓硫酸具有强氧化性,在加热的条件下会氧化HBr,生成溴单质,其反应方程式为:2HBr+H2SO4(浓)![]() SO2↑+Br2↑+2H2O,液溴的沸点比较低,在高温的条件下挥发,所以会产生大量红棕色气体;正丁醇在浓硫酸的作用下会发生消去反应,生成CH2=CHCH2CH3,所以该制备反应中产生的有机副产物为CH2=CHCH2CH3。故答案:2HBr+H2SO4(浓)
SO2↑+Br2↑+2H2O,液溴的沸点比较低,在高温的条件下挥发,所以会产生大量红棕色气体;正丁醇在浓硫酸的作用下会发生消去反应,生成CH2=CHCH2CH3,所以该制备反应中产生的有机副产物为CH2=CHCH2CH3。故答案:2HBr+H2SO4(浓)![]() SO2↑+Br2↑+2H2O;CH2=CHCH2CH3;
SO2↑+Br2↑+2H2O;CH2=CHCH2CH3;
③因为溴化氢易溶于水,仪器C中的导管插入液面下,容易倒吸,所以应将仪器C中的导管换成漏斗,且漏斗边缘接近水面防止倒吸,故答案:将仪器C中的导管换成漏斗,且漏斗边缘接近水面;
(2) ①根据装置图可知仪器D的名称是尾接管;
②因为1-溴丁烷是不溶于水的油状液体,所以可用盛有少量水的小试管,收集几滴管出液,若无油珠则已蒸完,或观察管出液是否由浑浊变为澄清、烧瓶中层油层是否完全消失,故答案:用盛有少量水的小试管,收集几滴管出液,若无油珠则已蒸完(或观察流出液是否由浑浊变为澄清、烧瓶中层油层是否完全消失或温度计显示温度发生改变等);
(3) ①因为正丁醚和正丁醇能溶于浓硫酸,而1-溴丁烷不溶于浓硫酸,所以浓硫酸的主要作用是除去正丁醚及少量正丁醇,故答案:除去正丁醚及少量正丁醇;
②用10mL 10%碳酸钠溶液显碱性,且碳酸钠溶液遇到酸会放出二氧化碳气体,所以洗涤时必须的操作是开启活塞放气,故答案:开启活塞放气;
(4)根据方程式可知

解得x=13.64g,所以1-溴丁烷的产率=![]() 100%
100%![]() 60%,故答案:60。
60%,故答案:60。

 ABC考王全优卷系列答案
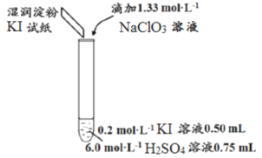
ABC考王全优卷系列答案【题目】某同学模拟工业制碘的方法,探究ClO3-和I-的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 1 | 0.05mL | 浅黄色 | 无色 |
2 | 0.20mL | 深黄色 | 无色 | |
3 | 0.25mL | 浅黄色 | 蓝色 | |
4 | 0.30mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
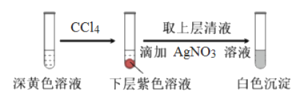
经检验,上述白色沉淀是AgCl。写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式____________。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2,反应的离子方程式是______________________。
进行实验:取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。其中试剂X可以是_________(填字母序号)。
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
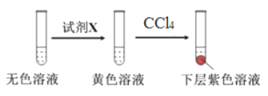
获得结论:NaClO3溶液用量增加导致溶液褪色。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0mol·L-1H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25mL | 浅黄色 | 无色 |
6 | 0.85mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是______________________。
②实验6中ClO3-和I-反应的离子方程式是______________________。