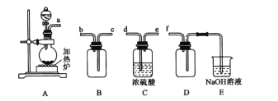
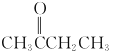题目内容
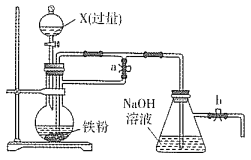
【题目】甲醇(CH3OH)热值高、无污染,既可做燃料,又是重要的化工原料。科学家正研究利用CO2生产甲醇以发展低碳经济。
(1)已知CO(g)和CH3OH(l)的燃烧热分别为283kJmol-1和726kJmol-1。则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______。
(2)根据甲醇在酸性电解质溶液中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池,则其负极反应式为______。若该燃料电池消耗1mol甲醇所能产生的最大电能为689.7kJ,与其燃烧所能释放的全部能量相比,该燃料电池的理论效率为______。
(3)探究不同条件下对合成甲醇反应的影响:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
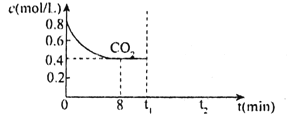
①其他条件不变,T1、T2两种温度下CH3OH的物质的量随时间的变化如图,则该反应在T1时的平衡常数比T2时的______(填“大”、“小”),处于A点的反应体系从T1变到T2,达到平衡时 ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
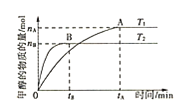
②某温度下,在体积为1L的密闭容器中加入4molCO2、8molH2,测得H2的物质的量随时间变化如图曲线(甲)所示:

则a→b时间段内v(CH3OH)=______molL-1min-1;若仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线(乙)所示。曲线(乙)对应改变的实验条件可以是______(填序号)。
A.加催化剂 B.增大压强 C.升高温度 D.增大CO2浓度
若图中曲线甲平衡后保持恒温恒容,按如表各组的物质的量再次增加投入反应混合物,其中平衡向正反应方向进行的是______。
物质 | n(CO2) | n(H2) | n(CH3OH) | n(H2O) |
A | 0 | 0 | 1 | 1 |
B | 1 | 0 | 1 | 0 |
C | 0 | 1 | 1 | 0 |
【答案】CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443kJmol-1 CH3OH-6e-+H2O=CO2+6H+ 95% 大 增大 0.5 BD C
【解析】
(1)根据CO(g)和CH3OH(l)的燃烧热,写出热化学方程式,再根据盖斯定律分析解答;
(2)燃料电池中,通入燃料的电极做负极,则负极为甲醇放电生成CO2,据此书写电极反应式;燃料电池的理论效率=![]() ×100%;
×100%;
(3)①根据图象,结合平衡移动原理进行分析;②由图可知:a→b时间段内,△n(H2)=3mol,△t=2min,据此计算v(H2)=,v(CH3OH)=![]() v(H2);根据影响化学平衡的因素分析判断;先根据三段式求出平衡常数K,再根据Qc与K比较判断平衡移动的方向。
v(H2);根据影响化学平衡的因素分析判断;先根据三段式求出平衡常数K,再根据Qc与K比较判断平衡移动的方向。
(1)CO(g)的燃烧热的热化学方程式为:①CO(g)+![]() O2(g)=CO2(g) △H=-283kJmol-1;CH3OH(l)的燃烧热的热化学方程式为:②CH3OH(l)+
O2(g)=CO2(g) △H=-283kJmol-1;CH3OH(l)的燃烧热的热化学方程式为:②CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-726kJmol-1,根据盖斯定律:反应②-反应①即可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-726kJmol-1+283kJmol-1 = -443kJmol-1,故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-726kJmol-1,根据盖斯定律:反应②-反应①即可得甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-726kJmol-1+283kJmol-1 = -443kJmol-1,故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443kJmol-1;
(2)对于燃料电池,燃料做负极,则负极为甲醇放电生成CO2,根据电子转移、电荷守恒,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;该燃料电池的理论效率=![]() ×100%=95%,故答案为:CH3OH-6e-+H2O=CO2+6H+;95%;
×100%=95%,故答案为:CH3OH-6e-+H2O=CO2+6H+;95%;
(3)①由图可知,T1温度下,平衡时甲醇的物质的量更多,所以T1时的平衡常数比T2时的大;T2温度下反应先达平衡,则T2>T1,且甲醇的物质的量减少,说明平衡逆移,正反应为放热反应,处于A点的反应体系从T1变到T2,相当于升高温度,平衡逆移,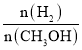 增大,故答案为:大;增大;
增大,故答案为:大;增大;
②由图可知:a→b时间段内,△n(H2)=3mol,△t=2min,则v(H2)=![]() =
=![]() =
=![]() =1.5mol/(Lmin),v(CH3OH)=
=1.5mol/(Lmin),v(CH3OH)=![]() v(H2)=0.5mol/(Lmin);A、加入催化剂,平衡不移动, H2平衡的物质的量不变,故A错误;B、增大压强,反应速率加快,平衡正移,H2的物质的量减小,符合图象变化,故B正确;C、升高温度,反应速率加快,平衡逆移,H2的物质的量增大,不符合图象变化,故C错误;D、增大CO2浓度,反应速率加快,平衡正移,H2的物质的量减小,符合图象变化,故D正确;故选BD;
v(H2)=0.5mol/(Lmin);A、加入催化剂,平衡不移动, H2平衡的物质的量不变,故A错误;B、增大压强,反应速率加快,平衡正移,H2的物质的量减小,符合图象变化,故B正确;C、升高温度,反应速率加快,平衡逆移,H2的物质的量增大,不符合图象变化,故C错误;D、增大CO2浓度,反应速率加快,平衡正移,H2的物质的量减小,符合图象变化,故D正确;故选BD;
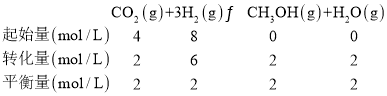
平衡常数K=![]() =
=![]() =0.25(mol/L)-2,A、只加生成物,则平衡逆移,故A错误;B、Qc=
=0.25(mol/L)-2,A、只加生成物,则平衡逆移,故A错误;B、Qc=![]() =0.25=K,平衡不移动,故B错误;C、Qc=
=0.25=K,平衡不移动,故B错误;C、Qc=![]() =0.11<K,平衡正移,故C正确;故选C,故答案为:0.5;BD;C。
=0.11<K,平衡正移,故C正确;故选C,故答案为:0.5;BD;C。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
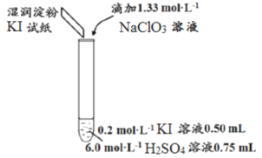
超能学典应用题题卡系列答案【题目】某同学模拟工业制碘的方法,探究ClO3-和I-的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 1 | 0.05mL | 浅黄色 | 无色 |
2 | 0.20mL | 深黄色 | 无色 | |
3 | 0.25mL | 浅黄色 | 蓝色 | |
4 | 0.30mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
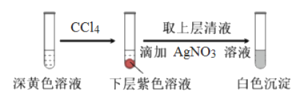
经检验,上述白色沉淀是AgCl。写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式____________。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2,反应的离子方程式是______________________。
进行实验:取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。其中试剂X可以是_________(填字母序号)。
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
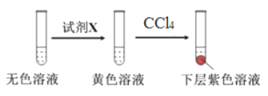
获得结论:NaClO3溶液用量增加导致溶液褪色。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0mol·L-1H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25mL | 浅黄色 | 无色 |
6 | 0.85mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是______________________。
②实验6中ClO3-和I-反应的离子方程式是______________________。