题目内容
【题目】如图是元素周期表的一部分,所列字母分别代表一种化学元素。下列说法正确的是( )
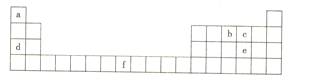
A.b的第一电离能小于c的第一电离能
B.d在c的常见单质中燃烧,产物中既含有离子键也含有共价键
C.e与a组成的化合物沸点比水低,原因是水分子之间可形成氢键
D.f元素的基态原子失去4s能级上的所有电子后所形成的离子最稳定
【答案】BC
【解析】
由元素在周期表中位置可知,a为H、b为N、c为O、d为Na、e为S、f为Fe。
A.N元素的2p轨道为半充满稳定结构,第一电离能高于氧元素的第一电离能,故A错误;
B.Na在氧气中燃烧生成过氧化钠,过氧化钠中含有离子键、共价键,故B正确;
C.水分子之间存在氢键,硫化氢分子之间为范德华力,氢键比范德华力强,因此硫化氢的沸点低于水,故C正确;
D.Fe2+离子价电子为3d6,而Fe3+离子价电子为3d5稳定结构,Fe2+离子不如Fe3+离子稳定,故D错误;
故选BC。

 第1卷单元月考期中期末系列答案
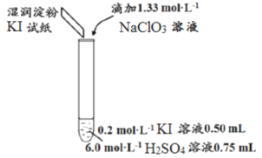
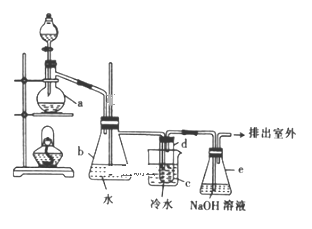
第1卷单元月考期中期末系列答案【题目】某同学模拟工业制碘的方法,探究ClO3-和I-的反应规律。实验操作及现象如下:
实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 1 | 0.05mL | 浅黄色 | 无色 |
2 | 0.20mL | 深黄色 | 无色 | |
3 | 0.25mL | 浅黄色 | 蓝色 | |
4 | 0.30mL | 无色 | 蓝色 |
(1)取实验2后的溶液,进行如下实验:
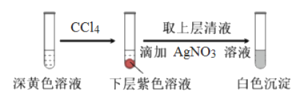
经检验,上述白色沉淀是AgCl。写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式____________。
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-。
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2,反应的离子方程式是______________________。
进行实验:取少量实验4中的无色溶液进行以下实验,进一步佐证其中含有IO3-。其中试剂X可以是_________(填字母序号)。
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
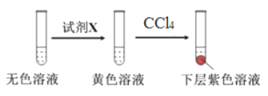
获得结论:NaClO3溶液用量增加导致溶液褪色。
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如下实验结果:
编号 | 6.0mol·L-1H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
5 | 0.25mL | 浅黄色 | 无色 |
6 | 0.85mL | 无色 | 蓝色 |
①对比实验4和5,可以获得的结论是______________________。
②实验6中ClO3-和I-反应的离子方程式是______________________。