题目内容
20.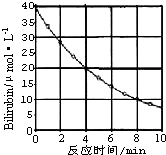 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算:
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算:反应4~8min间的平均反应速率为2.5μ mol/(L•min).
请根据图象中化合物Bilirubin浓度变化规律,推测反应16min时反应物的浓度是Aμmol•L-1.
A.2.5 B.5.0 C.7.5 D.10.
分析 根据v=$\frac{△c}{△t}$计算反应4~8min间的平均反应速率;
0~4 min期间,反应物浓度变化为(40-20)μmol/L=20μmol/L,4~8 min期间,反应物浓度变化为(20-10)μ mol/L=10μmol/L,可知,每隔4分钟,速率降为原来的一半.据此计算.
解答 解:由图可知,4~8 min期间,反应物浓度变化为(20-10)μ mol/L=10μmol/L,
所以4~8 min期间,反应速率为$\frac{10μmol/L}{4min}$=2.5μ mol/(L•min).
由图可知,0~4 min期间,反应物浓度变化为(40-20)μmol/L=20μmol/L,4~8 min期间,反应物浓度变化为(20-10)μ mol/L=10μmol/L,可知,每隔4分钟,浓度变化量降为原来的一半.
所以8~12min浓度变化为5μ mol/L,12~16min浓度变化为2.5μ mol/L.
所以16min时浓度为10μ mol/L-5μ mol/L-2.5μ mol/L=2.5μ mol/L.
故答案为:2.5μ mol/(L•min);A.
点评 考查反应速率的有关计算,难度中等,根据图中浓度变化判断相同时间内的浓度变化量是解题关键.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
11.在汽车尾气排气管里装入三元催化剂,可发生如下反应以减小污染物排放:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)关于该可逆反应的下列说法中,不正确的是( )
| A. | 升高温度,正反应速率加快,逆反应速率减慢 | |
| B. | NO不可能全部转化为N2 | |
| C. | CO的转化率为最大值时,该反应达到平衡状态 | |
| D. | 单位时间内消耗NO和CO2的物质的量相等时,反应达到平衡状态 |
8.常温下水的离子积常数为K1;90℃水的离子积常数为K2,则K1、K2的关系是( )
| A. | K1>K2 | B. | K1<K2 | ||
| C. | K1=K2 | D. | 视溶液的酸碱性而定 |
5.下列结论错误的是( )
| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 微粒半径:K+>Al3+>S2->Cl- | |
| C. | 酸性:H2SO4>CH3COOH>H2CO3>HClO | |
| D. | 金属性:K>Ca>Mg>Be |
12.下列每组的三种物质中,两边的固体均用导线连接,插入中间的液体中,其中能组成原电池的是( )
| A. | Fe|H2SO4(稀)|石墨 | B. | Cu|H2SO4(稀)|Cu | C. | Cu|CCl4|Ag | D. | Zn|蔗糖溶液|Cu |
9.某有机物的结构简式如图,关于该有机物性质的描述不正确的是( )
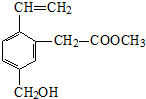
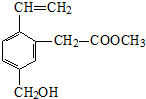
| A. | 能发生水解反应 | B. | 能发生酯化反应 | ||
| C. | 不易溶于水 | D. | 不能使酸性KMnO4溶液褪色 |
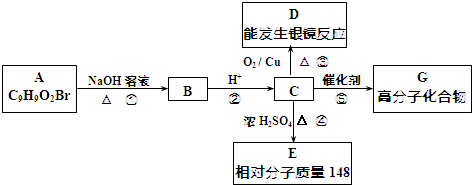
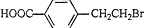 .
.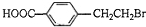 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$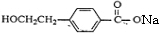 +NaBr+H2O.反应⑤的化学方程式是
+NaBr+H2O.反应⑤的化学方程式是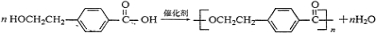 .
.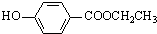 、
、 、还有4种.
、还有4种.