题目内容
5.下列结论错误的是( )| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 微粒半径:K+>Al3+>S2->Cl- | |
| C. | 酸性:H2SO4>CH3COOH>H2CO3>HClO | |
| D. | 金属性:K>Ca>Mg>Be |
分析 A、元素的非金属性越强,对应的氢化物越稳定;
B、原子核外电子排布相同的离子,核电核数越大,半径越大,离子的原子核外电子层数越多,半径越大;
C、硫酸是强酸,CH3COOH、H2CO3、HClO都是弱酸,醋酸的酸性强于碳酸,碳酸的酸性强于次氯酸;
D、同周期元素从左到右元素的金属性逐渐减弱,同主族元素从上到下元素的金属性逐渐增强.
解答 解:A、非金属性:F>Cl>S>P>Si,元素的非金属性越强,对应的氢化物越稳定,则氢化物的稳定性:HF>HCl>H2S>PH3>SiH4,故A正确;
B、K+、S2-、Cl-原子核外电子排布相同,核电核数S2-<Cl-<K+,则半径S2->Cl->K+,离子的原子核外电子层数越多,半径越大,核外电子层数最小,则半径最小,则有S2->Cl->K+>Al3+,故B错误;
C、硫酸是强酸,CH3COOH、H2CO3、HClO都是弱酸,醋酸的酸性强于碳酸,碳酸的酸性强于次氯酸,则有酸性:H2SO4>CH3COOH>H2CO3>HClO,故C正确;
D、同周期元素从左到右元素的金属性逐渐减弱,则金属性Ca<K,同主族元素从上到下元素的金属性逐渐增强,则金属性Be<Mg<Ca,所以金属性:Be<Mg<Ca<K,故D正确.
故选:B.
点评 本题考查元素周期表与周期律的递变性,题目难度中等,建议采用排除法可节省时间,学习中注重基础知识的积累.

练习册系列答案
相关题目
15.如图是某只含有C、H、O、N的有机物简易球棍模型.下列关于该有机物的说法错误的是( )
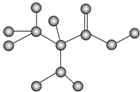

| A. | 该有机物的分子式为C3H7O2N | B. | 该有机物的名称为α氨基丙酸 | ||
| C. | 该有机物能发生加成反应 | D. | 该有机物分子之间能发生聚合反应 |
16.下列各组微粒具有相同的质子数和电子数的是( )
| A. | OH-、H2O、F- | B. | Na+、NH4+、H3O+ | C. | H3O+、NH4+、NH2- | D. | Cl-、K+、H2S |
13.锌粒与稀盐酸反应,对锌粒的消耗速率进行计量时,下列单位中不能使用的是( )
| A. | mol/L•s | B. | mol/s | C. | mol/min | D. | g/s |
10.工业制硫酸中的一步重要反应是SO2在400~500℃的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A. | 使用催化剂可以加快反应速率,提高生产效率 | |
| B. | 适当提高O2的浓度可以提高SO2的转化率 | |
| C. | 达到平衡时,正反应速率和逆反应速率都为零 | |
| D. | 达到平衡时,SO2、O2、SO3的物质的量浓度不再变化 |
17.下列定律或原理:①质量守恒定律,②能量守恒定律,③元素周期律,④勒夏特列原理,其中能够适用于2NH3(g)?N2(g)+3H2(g)△H<0这一化学反应的是( )
| A. | 只有④ | B. | ①和③ | C. | ①②④ | D. | ①②③ |
14.已知:氢氧化镁能溶于浓度均为3mol•L-1的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是( )
| A. | c(NH4+):③>② | |
| B. | Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)右移 | |
| C. | pH:③>②>① | |
| D. | 将等体积的①和③混合,所得溶液中 c(Cl-)+c(CH3COO-)=c(NH4+)+c(H+) |
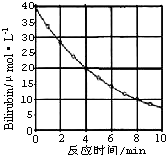 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算:
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算: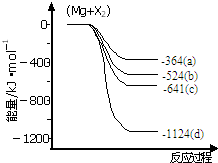 镁化合物具有广泛用途,请回答有关镁的下列问题:
镁化合物具有广泛用途,请回答有关镁的下列问题: