题目内容
8.常温下水的离子积常数为K1;90℃水的离子积常数为K2,则K1、K2的关系是( )| A. | K1>K2 | B. | K1<K2 | ||
| C. | K1=K2 | D. | 视溶液的酸碱性而定 |
分析 水的电离是吸热反应,升高温度促进水电离,则水中c(H+)、c(OH-)都增大,水的离子积常数Kw=c(H+).c(OH-),据此分析解答.
解答 解:水的电离是吸热反应,升高温度促进水电离,则水中c(H+)、c(OH-)都增大,水的离子积常数Kw=c(H+).c(OH-),所以温度应该水的离子积常数越大,常温下水的离子积常数为K1,90℃水的离子积常数为K2,所以K1<K2,故选B.
点评 本题考查离子积常数有关知识,离子积常数只与温度有关,与溶液酸碱性及浓度无关,升高温度离子积常数增大,题目难度不大.

练习册系列答案
相关题目
18.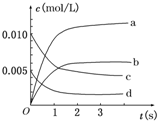 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
(1)用O2表示0~2s内该反应的平均速率v=0.0015mol/(L•s);
(2)图中a、b、c、d四条曲线中表示SO3浓度随时间变化的是b;
(3)恒温恒容条件下,能说明该反应已达到平衡状态的是BC.
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v逆(SO2)=2v正(O2) D.容器内密度保持不变.
 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)?2SO3(g)体系中,n(SO2)随时间的变化如下表:| 时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中a、b、c、d四条曲线中表示SO3浓度随时间变化的是b;
(3)恒温恒容条件下,能说明该反应已达到平衡状态的是BC.
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.v逆(SO2)=2v正(O2) D.容器内密度保持不变.
19.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+11.9kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在25℃,101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
16.下列各组微粒具有相同的质子数和电子数的是( )
| A. | OH-、H2O、F- | B. | Na+、NH4+、H3O+ | C. | H3O+、NH4+、NH2- | D. | Cl-、K+、H2S |
3.下列不能由两种单质直接化合得到的物质是( )
| A. | FeCl3 | B. | CuCl2 | C. | FeS | D. | CuS |
13.锌粒与稀盐酸反应,对锌粒的消耗速率进行计量时,下列单位中不能使用的是( )
| A. | mol/L•s | B. | mol/s | C. | mol/min | D. | g/s |
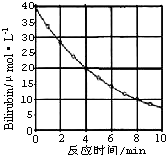 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算:
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算: