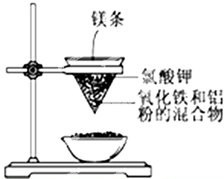
题目内容
9.某有机物的结构简式如图,关于该有机物性质的描述不正确的是( )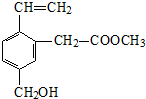
| A. | 能发生水解反应 | B. | 能发生酯化反应 | ||
| C. | 不易溶于水 | D. | 不能使酸性KMnO4溶液褪色 |
分析 该物质中含有碳碳双键、酯基、苯环和醇羟基,具有烯烃、酯、苯和醇的性质,能发生加成反应、加聚反应、氧化反应、还原反应、水解反应、酯化反应等,据此分析解答.
解答 解:A.含有酯基,所以能发生水解反应,故A正确;
B.含有醇羟基,所以能发生酯化反应,故B正确;
C.憎水基基团较大,所以不易溶于水,故C正确;
D.含有碳碳双键,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系即可解答,侧重考查醇、烯烃、酯的性质,题目难度不大.

练习册系列答案
相关题目
19.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+11.9kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在25℃,101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
17.下列定律或原理:①质量守恒定律,②能量守恒定律,③元素周期律,④勒夏特列原理,其中能够适用于2NH3(g)?N2(g)+3H2(g)△H<0这一化学反应的是( )
| A. | 只有④ | B. | ①和③ | C. | ①②④ | D. | ①②③ |
4.按酸碱质子理论,下列粒子既可看作酸又可看作碱的是( )
| A. | CH3COO- | B. | NH4+ | C. | OH- | D. | HCO3- |
14.已知:氢氧化镁能溶于浓度均为3mol•L-1的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是( )
| A. | c(NH4+):③>② | |
| B. | Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)右移 | |
| C. | pH:③>②>① | |
| D. | 将等体积的①和③混合,所得溶液中 c(Cl-)+c(CH3COO-)=c(NH4+)+c(H+) |
1.25℃时,水中存在电离平衡:H2O?H++OH-,△H>0.下列叙述正确的是( )
| A. | 将水加热,KW增大,pH不变 | |
| B. | 向水中加入少量的NaOH固体,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量的NH4Cl固体,平衡逆向移动,溶液呈碱性 | |
| D. | 向0.1mol/L的醋酸溶液中加入一定量的醋酸钠晶体,溶液中的c(OH-)增大,KW不变 |
19.下列对应化学反应的离子方程式正确的是( )
| A. | 向磷酸二氢铵溶液中加入足量氢氧化钠溶液:NH4++OH-═NH3•H2O | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | FeSO4溶液在空气中放置变质:4Fe2++O2+2H2O═4Fe3++4OH- | |
| D. | 过量SO2通入冷氨水中:SO2+NH3•H2O=HSO3-+NH4+ |
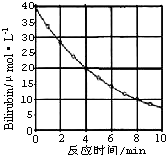 化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算:
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算: