题目内容
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| 元素化合物的性质 |  | 形成常见的两性氧化物 | Z2是常见保护气 | W3可用于杀菌消毒 |
下列叙述正确的是
A.W的气态氢化物比Z的气态氢化物稳定
B.X、Y元素的金属性X<Y
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,Z单质与W的常见单质直接生成ZW2
A
解析试题分析:O3具有强氧化性,可用于杀菌消毒,则W是氧,N2是常见保护气,则Z是氮,第二周期元素中,氧元素的非金属性比氮强,则氧元素的气态氢化物比氮元素的气态氢化物稳定,故A正确;Al2O3是常见的两性氧化物,则Y是铝,根据最高正价等于主族序数,根据原子半径推断X是镁,第三周期元素中镁的金属性大于铝,故B错误;稀氨水是弱碱溶液,氢氧化铝是两性氢氧化物,后者能溶于盐酸、氢氧化钠等强酸、强碱溶液,不溶于弱碱溶液和弱酸溶液,故C错误;氮气与氧气在放电或高温下反应,直接生成一氧化氮,不能直接变为二氧化氮,故D错误。
考点:考查元素周期表与元素周期律,涉及镁铝氧氮四种元素及其化合物的主要性质与元素在周期表中位置之间的关系。

练习册系列答案
相关题目
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH >Ba(OH)2 |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH﹤Ba(OH)2 |
X、Y、Z为短周期非金属元素,其相关性质如下:
| 元素 | X | Y | Z |
| 与H2反应条件 | 暗处反应 | 光照 | 高温、催化剂 |
| 常温下氢化物水溶液的pH | 小于7 | 小于7 | 大于7 |
A.非金属性X<Y
B.Z为第VA族元素
C.最外层电子数Z>Y
D.Y、Z的氢化物反应形成离子化合物
下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是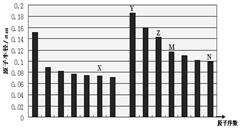
| A.非金属性:X>N |
| B.气态氢化物的稳定性:M<N |
| C.X和Y形成的化合物中只可能含离子键 |
| D.化合物MX2能与碱反应,不能与任何酸反应 |
X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列说法正确的是
| A.原子序数X<Y | B.原子半径X>Y |
| C.原子的最外层电子数X>Y | D.元素的最高正价X<Y |
