题目内容
18.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3s内的v(H2)=0.3mol•L-1•s-1,则3s末NH3的浓度为( )| A. | 0.45 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.9 mol•L-1 | D. | 1.2 mol•L-1 |
分析 利用速率之比等于化学计量数之比计算v(NH3),再利用△c=v△t计算2s末NH3的浓度.
解答 解:发生反应N2+3H2?2NH3,3s内氢气的平均速率:ν(H2)=0.3mol/(L•s),速率之比等于化学计量数之比,则v(NH3)=23×ν(H2)=23×0.3mol/(L•s)=0.2mol/(L•s),故3s末NH3的浓度为0.2mol/(L•s)×3s=0.6mol/L,故选B.
点评 本题考查反应速率的有关计算,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
相关题目
8.一定量的乙醇在氧气不足的情况下燃烧,得到CO2、CO和H2O的总质量为13.8g,其中H2O的质量为5.4g,则CO的质量是( )
| A. | 0.7g | B. | 1.1 g | ||
| C. | 2.2 g | D. | 在1.1g和2.2g之间 |
9.可用自由电子与金属离子的碰撞中有能量传递来解释的物理性质是( )
| A. | 金属是热的良导体 | B. | 金属是电的良导体 | ||
| C. | 金属有良好的延展性 | D. | 有金属光泽,不透明 |
6.下列各组物质中,能用酸性高锰酸钾溶液鉴别的是( )
| A. | 乙烯、乙炔 | B. | 乙烯、丙烯 | C. | 苯、乙烷 | D. | 苯、甲苯 |
13.如图所示的装置中,能够组成原电池,产生电流的是( )
| A. |  | B. | 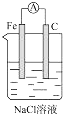 | C. |  | D. | 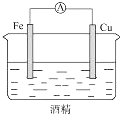 |
3.某烯烃加氢后产物的结构简式为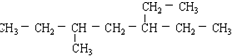 ,此烯烃可能的结构有( )
,此烯烃可能的结构有( )
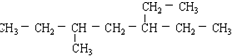 ,此烯烃可能的结构有( )
,此烯烃可能的结构有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
10.室温下,稀氨水中存在电离平衡NH3•H2O?NH4++OH-,有关叙述正确的是( )
| A. | 加入氯化铵固体,溶液中c(H+)c(OH−)减小 | |
| B. | 加水不断稀释,溶液碱性一定增强 | |
| C. | 加水稀释,平衡常数Kb增大 | |
| D. | 加入NaOH固体,平衡逆向移动 |
18.下列有关碱金属铷(Rb)的叙述中,错误的是( )
| A. | 灼烧硝酸铷时,火焰有特殊颜色 | |
| B. | 氯化铷是离子化合物 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷是弱碱 |
