题目内容
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用化学原理吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如下(Ce为铈元素):

请回答下列问题:
(1)写出装置I中主要发生反应的离子方程式_______________________;
装置Ⅱ中NO在酸性条件下生成NO3-的离子方程式______________________。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω(纵坐标)与溶液pH(横坐标)的关系如下图所示:
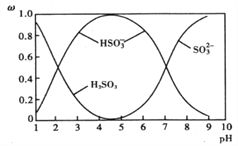
①下列说法不正确的是__________(填标号)
A. 为获得尽可能纯的NaHSO3,应将溶液的pH控制在4~5为宜
B. pH=7时,溶液中:c(Na+)<c(HSO3-)+c(SO32-)
C. pH=9时,溶液中:c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②由图中数据,可以计算出H2SO3的第二级电离平衡常数K2约为_______
(3)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,其pH降为2,结合化学平衡移动原理用有关的化学用语解释溶液pH降低的原因______________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4mol·L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为__________L。
【答案】 SO2 + OH-=HSO3- 3Ce4++NO+2H2O=NO3-+3Ce3++4H+ B 10-7 HSO3-SO32-+H+,加入CaCl2溶液,Ca2++SO32-= CaSO3↓,使平衡右移,c(H+)增大 4480
【解析】装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,装置Ⅳ中通入氨气、氧气,2NO2-+O2+2H++2NH3=2NH4++2NO3-。
(1)根据上述分析,装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠反应:SO2+OH-=HSO3-;装置Ⅱ中NO在酸性条件下生成NO3-的离子方程式为NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,故答案为:SO2+OH-=HSO3-;NO+2H2O+3Ce4+=3Ce3++NO3-+4H+;
(2)①A.溶液的pH控制在4~5时,c(HSO3- )浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故A正确;B.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故B错误;C.溶液存在质子守恒,应为c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3),故C正确;故答案为: B;
②HSO3-SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- ),由Ka的表达式可知,H2SO3的第二级电离平衡常数K2≈c(H+)=10-7,故答案为:10-7;
(3)NaHSO3溶液中HSO3-的电离大于水解,HSO3- ![]() SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓,使电离平衡右移,故答案为:HSO3-在溶液中存在电离平衡:HSO3-
SO32-+H+,溶液显示酸性,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓,使电离平衡右移,故答案为:HSO3-在溶液中存在电离平衡:HSO3- ![]() SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大;
SO32-+H+,加CaCl2溶液后,Ca2++SO32-=CaSO3↓使电离平衡右移,c(H+)增大;
(4)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数为:1000×(5-3)×0.4mol,设消耗标况下氧气的体积是V,根据电子守恒: ![]() ×4=1000×(5-3)×0.4mol,解得V=4480L,故答案为:4480。
×4=1000×(5-3)×0.4mol,解得V=4480L,故答案为:4480。

 阅读快车系列答案
阅读快车系列答案

