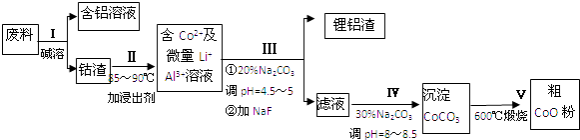
题目内容
【题目】两份铝,一份加入足量强碱溶液中,另一份加入足量盐酸中,要使前后反应收集到的氢气量之比为1:2,则两份铝质量比为( )
A.1:2
B.2:1
C.1:4
D.1:1
【答案】A
【解析】解:盐酸与NaOH溶液足量,则铝完全反应,设铝与盐酸、NaOH溶液反应生成的氢气的物质的量分别为xmol、2xmol,则2Al+6HCl=2AlCl3+3H2↑
2 3![]() x
x
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3![]() 2x
2x
则第一份与第二份铝屑的质量比为:( ![]() mol×27g/mol):(
mol×27g/mol):( ![]() mol×27g/mol)=1:2,
mol×27g/mol)=1:2,
故选A.
【考点精析】解答此题的关键在于理解铝的化学性质的相关知识,掌握很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应.

【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)<c(CO2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生反应的类型和条件都正确的是( )
选项 | 反应类型 | 反应条件 |
A | 加成反应、取代反应、消去反应 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
C | 氧化反应、取代反应、消去反应 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A.A
B.B
C.C
D.D