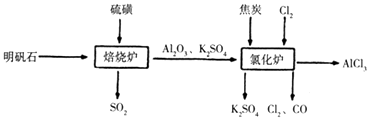
题目内容
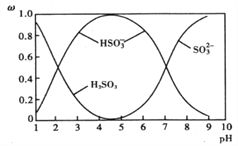
【题目】在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法正确的是

A. Ksp(CuCl)的数量级为10-5
B. 加入Cu越多,Cu+浓度越高,除Cl-效果越好
C. 若有32g Cu参加反应,转移电子的数目为NA
D. 除Cl-反应为Cu+Cu2++2 Cl-=2CuCl
【答案】D
【解析】涉及的反应物为铜、硫酸铜以及氯离子,生成物为CuCl,反应的方程式为Cu+Cu2++2Cl-=2CuCl。A.由图像可知,横坐标为1时,表示c(Cl-)=0.1,lgc(Cu+)在-5~-6之间,即10-6<c(Cu+)<10-5,则Ksp(CuCl)= c(Cu+)c(Cl-)在10-7~10-6之间,故A错误;B.发生Cu+Cu2++2Cl-=2CuCl,反应的效果取决于Cu2+的浓度,如Cu2+不足,则加入再多的Cu也不能改变效果,故B错误;C. 32g Cu为0.5mol,根据方程式,转移电子的数目为0.5NA,故C错误;D.根据分析,反应的方程式为Cu+Cu2++2Cl-=2CuCl,故D正确;故选D。

练习册系列答案
相关题目