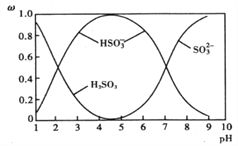
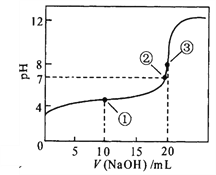
题目内容
【题目】25 ℃时,氢离子浓度都为1×10-2 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入003 g Zn粉,在相同条件下充分反应,下列有关叙述正确的是
A. 稀释2倍后,两溶液的pH:盐酸小于醋酸
B. 盐酸和醋酸分别与Zn反应放出的氢气一样多
C. 盐酸和醋酸分别与Zn反应的速率一样大
D. 稀释2倍前,醋酸溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)
【答案】B
【解析】n(Zn)= ![]() ≈0.00046mol,根据Zn~2H+得,锌完全反应需要n(H+)=0.00046mol×2=0.00092mol,100mL,氢离子浓度都为1×10-2 mol·L-1的盐酸中n(HCl)=0.01mol/L×0.1L=0.001mol,所以盐酸略有剩余反应,氢离子浓度都为1×10-2 mol·L-1的醋酸浓度大于盐酸,所以100mL醋酸中醋酸的物质的量大于盐酸,醋酸过量较多。
≈0.00046mol,根据Zn~2H+得,锌完全反应需要n(H+)=0.00046mol×2=0.00092mol,100mL,氢离子浓度都为1×10-2 mol·L-1的盐酸中n(HCl)=0.01mol/L×0.1L=0.001mol,所以盐酸略有剩余反应,氢离子浓度都为1×10-2 mol·L-1的醋酸浓度大于盐酸,所以100mL醋酸中醋酸的物质的量大于盐酸,醋酸过量较多。
A.氢离子浓度都为1×10-2 mol·L-1的盐酸和醋酸各100 mL,醋酸的浓度大于盐酸,稀释2倍后,醋酸继续电离,稀释后两溶液的pH:盐酸大于醋酸,故A错误;B.醋酸过量、盐酸略有剩余反应,所以生成氢气的量与锌的质量成正比,两种溶液中锌的质量相等,所以放出的氢气一样多,故B正确;C.起始是氢离子浓度相同,反应速率相等,随着反应的进行,醋酸不断电离出氢离子,导致反应过程中醋酸中的氢离子浓度大于盐酸,则醋酸反应速率大于盐酸,故C错误;D.醋酸溶液中存在醋酸的电离和水的电离,根据电荷守恒c(CH3COO-)+ c( OH-)=c(H+),因此c(H+)>c(CH3COO-),故D错误;故选B。

 名校课堂系列答案
名校课堂系列答案【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生反应的类型和条件都正确的是( )
选项 | 反应类型 | 反应条件 |
A | 加成反应、取代反应、消去反应 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
C | 氧化反应、取代反应、消去反应 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A.A
B.B
C.C
D.D