题目内容
2.氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料.(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3.该可逆反应达到平衡的标志是BCE.
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(3)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(1)═H2O(g)△H=+44.0kJ•mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-87.0kJ•mol-1;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于400K下分解,平衡时体系压强为a Pa,若反应温度不变,将体系的体积增加50%,则体系的压强是a Pa(用含a的式子表示).
分析 (1)碱性燃料电池中,负极上燃料失电子发生氧化反应,同时注意电解质溶液是否参与反应;
(2)当可逆反应达到平衡状态时,正逆反应速率相等,各物质的质量、百分含量及浓度不变,对反应前后气体体积不相等反应压强不变,对恒容条件全气体反应密度不变,据此判断;
(3)同一温度下,容器中气体压强与总的物质的量成正比,根据压强计算平衡时混合气体的物质的量,再根据v=$\frac{△c}{△t}$计算氮气的平均反应速率;根据平衡时各物质的浓度计算其平衡常数;
(4)根据盖斯定律书写其热化学反应方程式;增大体积,相当于减小压强,可逆反应向气体体积增大的方向移动,根据平衡常数不变进行计算.
解答 解:(1)碱性燃料电池中,负极上燃烧失电子发生氧化反应,所以该原电池中负极上氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O;
(2)A.2v(H2)正=3v(NH3)逆时,该反应达到平衡状态,所以3v(H2)正=2v(NH3)逆时该反应没有达到平衡状态,故错误;
B.单位时间生成m mol N2的同时消耗3m mol H2,正逆反应速率相等,所以该反应达到平衡状态,故正确;
C.对反应前后气体体积不相等反应,容器内的总压强不再随时间而变化,反应体系中各物质的浓度不变,所以达到平衡状态,故正确;
D.无论该反应是否达到平衡状态,混合气体的密度不随时间变化,所以密度不能作为判断依据,故错误;
E.a molN≡N键断裂的同时,有6amolN-H键断裂,正逆反应速率相等,所以该反应达到平衡状态,故正确;
F.N2、H2、NH3的分子数之比为1:3:2时该反应不一定达到平衡状态,与反应物的初始浓度及转化率有关,故错误;
故选BCE;
(3)同一温度下,容器中气体压强与总的物质的量成正比,设平衡状态时混合气体的物质的量为x,
16.80:12.60=(1+3)mol:x,x=$\frac{4mol×12.60}{16.80}$=3mol,所以平衡时混合气体的物质的量为3mol,
设参加反应的氮气的物质的量为y,
N2(g)+3H2(g)?2NH3(g)物质的量减少
1mol 2mol
y (4-3)mol
1mol:2mol=y:(4-3)mol,
y=$\frac{1mol×(4-3)mol}{2mol}$=0.5mol,
则从反应开始到25min时,以N2表示的平均反应速率=$\frac{\frac{0.5mol}{2L}}{25min}$=0.01mol/(L.min),
平衡时,c(N2)=$\frac{0.5mol}{2L}$=0.25mol/L、c(H2)=$\frac{3mol-3×0.5mol}{2L}$=0.75mol/L、c(NH3)=$\frac{0.5mol×2}{2L}$=0.5mol/L,化学平衡常数K=$\frac{0.5×0.5}{0.25×(0.75)^{3}}$( mol/L)-2=2.37( mol/L)-2,
故答案为:0.01 mol/(L.min);2.37( mol/L)-2;
(4)①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(1)═H2O(g)△H=+44.0kJ•mol-1
据盖斯定律将方程式①+②-③得2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1,
增大容器容积时,假设平衡不移动,压强与体积成反比,将体系的体积增加50%,所以其压强为原来的$\frac{2}{3}$,实际上增大容器容积,压强减小,平衡向气体体积增大的方向移动,即向正反应方向移动,温度不变,平衡常数不变,可知达平衡时水蒸气浓度不变,所以压强仍为aPa,
故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1;a.
点评 本题考查较综合,涉及化学平衡计算、平衡判断、原电池原理等知识点,侧重考查知识运用能力,化学平衡判断时只有“反应前后改变的物理量”才能作为判断依据,难点是(4)题第二空,注意反应方程式②的特点,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| W | X | Y | |
| T | Z | ||
| M |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质TY2、WZ4在通常情况下状态相同 | |
| D. | M元素的单质具有半导体的特性,M与Z元素可形成化合物MZ4 |
| A. |  实验室制取并收集NH3 | B. | 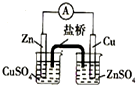 构成原电池 | ||
| C. | 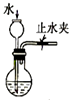 检查装置气密性 | D. |  利用排空气法收集CO2 |
| A. | 负极,被氧化 | B. | 正极,被还原 | C. | 负极,被还原 | D. | 正极,被氧化 |
| A. | 室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1 mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) |
| A. |  | B. |  | C. | 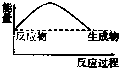 | D. | 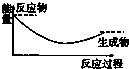 |
| A. | 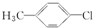 | B. | CH3CH2NO2 | C. | CH2=CHBr | D. | CΗ3-CH3 |
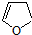 ,顺丁烯二酸酐
,顺丁烯二酸酐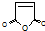 等药物中间体,广泛用于涂料行业的顺丁烯二酸二甲酯其合成流程图如下:
等药物中间体,广泛用于涂料行业的顺丁烯二酸二甲酯其合成流程图如下: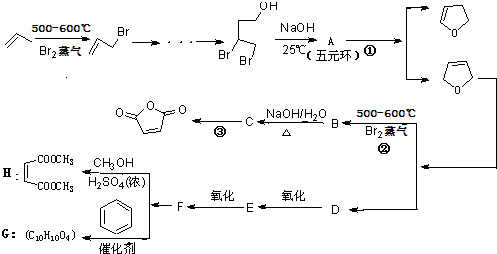
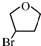 .D的结构简式HOCH2CH=CHCH2OH
.D的结构简式HOCH2CH=CHCH2OH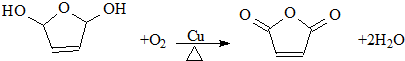 .
.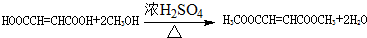 .
.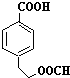 、
、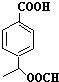 .
.