��Ŀ����
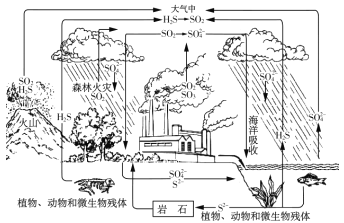
����Ŀ����������һ�ִ��ж�ṹ��ϸС������ɵ������Ͻ𣬱��㷺�����л�����⻯��Ӧ�Ĵ������Ժ�������(��Ҫ�ɷ�ΪNiS��FeS��SiO2��)Ϊԭ���Ʊ��������Ĺ�����������ͼ��ʾ��
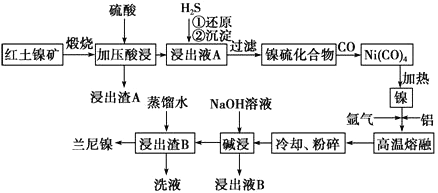
��1��������A����Ҫ�ɷ���_______________���ѧʽ����
��2����֪�����������պ�����Ni2O3������ѹ��������ҺA�к��д���Ni2����д���й���Ԫ�صļ�ѹ����Ļ�ѧ��Ӧ����ʽ_______________________________��
��3�������ҺA��ͨ��H2S���壬�ٻ�ԭ���������漰��Ҫ��Ӧ�����ӷ���ʽ��__________________________________��
��4�����γ�Ni(CO)4�Ĺ����У�̼Ԫ�صĻ��ϼ�û�б仯����Ni(CO)4�е�Ni�Ļ��ϼ�Ϊ________�� ��5�����������Ŀ����ʹ��������ṹ���Ӷ���ǿ��������ǿ�����ԣ��˹����з�����Ӧ�����ӷ���ʽΪ__________________________��
��6������ʱ����Ũ�Ⱦ�Ϊ1.0mol��L-1��FeSO4��NiSO4�Ļ����Һ�еμ�Na2S ���壬��Ni2+ǡ�ó�����ȫʱ��������Һ��c(Fe2+)=______________��
����֪����25�棬Ksp(NiS)=2.0��10-21��Ksp(FeS)=6.0��10-18
����Һ�е�����Ũ�ȡ�10-5 mol��L-1ʱ����Ϊ�����ӳ�����ȫ����
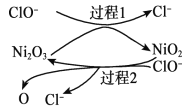
��7������ҺB���Ի��գ������������Ա�ѭ�����á�����ƼĻ������̣�
����ҺB��___________________________________________________________�� ����ͷ��ע����ӷ�Ӧ��Ļ�ѧʽ�ͷ�Ӧ��������(ʾ����![]() )
)
���𰸡� SiO2 2Ni2O3+4H2SO4==4NiSO4+O2��+4H2O H2S+2Fe3+==2Fe2++2H++S�� 0 2Al+2OH-+2H2O=2AlO2-+3H2�� 0.03mol/L ![]()
������������������Ҫ�ɷ�ΪNiS��FeS��SiO2�ȣ����շ���������ԭ��Ӧ�õ�Ni2O3��Fe2O3��SiO2����Ӧ�������������ѹ�����Ni2O3��Fe2O3�ܽ⣬�����ķ�Ӧ��2Ni2O3+4H2SO4=4NiSO4+O2��+4H2O��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��SiO2�������ᷴӦ�����˵õ�������A��SiO2��������ҺA�к�Ni2����Fe3���������ҺA��ͨ�� H2S���壬������ԭ��Ӧ�����ӷ���ʽ�ǣ�H2S+2Fe3��=2Fe2��+2H��+S���������ɳ���NiS�����˵õ�������NiS����ͨ��CO���壬�γ�Ni��CO��4�����ȵõ�������������ʱͨ����������������õ��Ͻ𣬽��Ͻ���ȴ�����飬����Ũ����������Һ����������������Ʒ�Ӧ��������ʹ�����Ͻ������Ľṹ������ҺB�к�ƫ����������������ˮϴ������B���õ���Ʒ����������1��������A����Ҫ�ɷ���SiO2���ѧʽ������2�������������պ�����Ni2O3������ѹ��������ҺA�к��д���Ni2�������Ļ��ϼ۽��ͷ�����ԭ��Ӧ��ֻ�����Ļ��ϼ������ߣ����Բ������������й���Ԫ�صļ�ѹ����Ļ�ѧ��Ӧ����ʽ 2Ni2O3+4H2SO4==4NiSO4+O2��+4H2O����3������ҺA�к�Ni2����Fe3���������ҺA��ͨ��H2S���壬���������н�ǿ�����ԣ������ⷢ����ԭ��Ӧ���ٻ�ԭ���������漰��Ҫ��Ӧ�����ӷ���ʽ��H2S+2Fe3+==2Fe2++2H++S������4�����γ�Ni(CO)4�Ĺ����У�̼Ԫ�صĻ��ϼ�û�б仯,̼Ϊ+2�ۣ���Ϊ-2�ۣ���Ni(CO)4�е�Ni�Ļ��ϼ�Ϊ0�� ��5�����������Ŀ����ʹ��������ṹ�������������Ʒ�Ӧ��������ʹ�����Ͻ������Ľṹ���Ӷ���ǿ��������ǿ�����ԣ��˹����з�����Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO2-+3H2������6����Ni2+ǡ�ó�����ȫʱ��Ksp(NiS)=2.0��10-21����c��S2����=2.0��10-21/10-5=2.0��10-16,������Һ��c(Fe2+)=6.0��10-18/2.0��10-16=0.03mol/L����7������ҺB�к�ƫ���������ͨ�����������̼�õ����������������ټ�������ʹ��ֽ�õ����������������ʯ��������̬�µ���������õ������������̿ɱ�ʾΪ������ҺB��![]() ��
��

 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д�����Ŀ��ij���¹̶����Ϊ2 L�ܱ������У�������Ӧ��2SO2(g)�� O2(g) ![]() 2SO3(g) ��H <0��n(SO2)��ʱ��ı仯�����
2SO3(g) ��H <0��n(SO2)��ʱ��ı仯�����
ʱ��/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
������˵����ȷ����
A. ��������������ܶȲ���ʱ��˵���÷�Ӧ�Ѵﵽƽ��״̬
B. ��O2��ʾ0��4 min�ڸ÷�Ӧ��ƽ������Ϊ0.005 mol/(L��min)
C. �������¶ȣ���SO2�ķ�Ӧ���ʻ���ƽ�ⳣ��Kֵ������
D. ƽ��ʱ��ͨ��18O2��ƽ�����ƣ��ٴ�ƽ��ʱ�����ʾ�����18O��O2��ת���ʼ�С