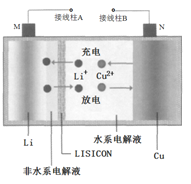
��Ŀ����
����Ŀ����ͼ��ʾװ�ã���������ȡ�۲�Fe(OH)2�ڿ����б���������ɫ�仯��ʵ��ʱ����ʹ����м��6 mol��L��1�����ᣬ�����Լ���ѡ��

��д���пհף�
��1��B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ������________��A�з�Ӧ�����ӷ���ʽ��________��
��2��ʵ�鿪ʼʱӦ�Ƚ�����a����Ŀ����____________________��
��3����������Fe(OH)2�IJ������̣�_______________________
��4��ʵ����ϣ���b������������һ���ֿ�������ʱB�з�����Ӧ�Ļ�ѧ����ʽΪ____��
��5��ͼ��________(��ܡ����ܡ�)�ϳ�ʱ�俴��Fe(OH)2��ɫ������
���𰸡���м Fe��2H��===Fe2����H2�� �ų�װ���еĿ��� ���ȴ�a���÷�Һ©������Һ���£�ʹA�в�����H2ͨ��B�У�һ��ʱ���ر�a����ƿ��ѹǿ����A��Һ���ص�������B�У�����������ɫ���� 4Fe(OH)2��O2��2H2O===4Fe(OH)3 ��
��������
Ϊ���ܽϳ�ʱ�俴��Fe(OH)2��ɫ������Ӧ�����������ų�װ�������������ȴ�d��Ȼ��ر�d��������������������ѹǿ������������Һѹ��B�������������������ݴ˽��
��1��A��ӦԤ��ʢ�Ź�̬��Ӧ����м������ϡ���ᷴӦ�����������������������ӷ�Ӧ����ʽΪFe+2H+��Fe2++H2����
��2��ʵ�鿪ʼʱ��Ӧ�ȴ���a��ʹ���ɵ�������������ʵ��װ���ж��ų���������ֹ������������������
��3��A�з�Ӧ������Ϊ��֤������������B�к��������ƻ�ϣ�Ҫ��������������ѹǿ�����ʵ�����Ϊ���ȴ�a���÷�Һ©������Һ���£�ʹA�в�����H2ͨ��B�У�һ��ʱ���ر�a����ƿ��ѹǿ����A��Һ���ص�������B�У�����������ɫ������
��4���������������ȶ����ױ������������ɺ��ɫ������������������ʵ����ϣ���b������������һ���ֿ�������ɫ������ת��Ϊ����ɫ���ת��Ϊ���ɫ����Ӧ�ķ���ʽΪ4Fe��OH��2+O2+2H2O��4Fe��OH��3��
��5���������Ϸ�����֪ͼ���ܽϳ�ʱ�俴��Fe(OH)2��ɫ������

 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д�����Ŀ��I����һ��������aA��bB![]() cC+dD�ﵽƽ��ʱ������д��
cC+dD�ﵽƽ��ʱ������д��
��1����A��B��C��D�������壬�ڼ�ѹ��ƽ�����淴Ӧ�����ƶ�����a��b��c��d��ϵ��__________________��
��2����֪B��C��D�����壬������A�����ʵ�����ƽ�ⲻ�ƶ���˵��A��__________________����״̬����
��3���������ݻ����䣬��������B������A��ת����__________________����������������С����������������
��4�������Ⱥ�C�İٷֺ�����С��������Ӧ��__________________��Ӧ��������������������������
��5������������ѹǿ���䣬��A��B��C��D�������壬�������г���ϡ�����壬��ѧƽ�������ƶ�����a��b��c��d��ϵ��__________________��
������ҵ��һ��������з�Ӧ�ϳɼ״���CO(g)��2H2(g) ![]() CH3OH(g)��
CH3OH(g)��
��1����һ���¶��£���2 mol CO��6 mol H2����2 L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c(CO)��0.5mol��L��1���÷�Ӧ��ƽ�ⳣ��K��__________________��
��2������һ����ɱ�������г���l molCO�� 2mol H2��1mol CH3OH���ﵽƽ�ⅼ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6������÷�Ӧ��__________________(����������������)��Ӧ�����ƶ���
��3�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�˷�Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
���� | ��Ӧ��Ͷ����� | ��Ӧ���ת���� | CH3OH��Ũ��(mol/L) | �����仯��Q1��Q2��Q3������0�� |
1 | 2molCO��4molH2 | a1�� | c1 | �ų�Q1kJ���� |
2 | 2molCH3OH | a2�� | c2 | ����Q2kJ���� |
3 | 4molCO��8molH2 | a3�� | c3 | �ų�Q3kJ���� |
�����й�ϵ��ȷ���� __________________��
A�� c1=c2 B��2Q1=Q3 C��2a1=a3 D��a1 +a2 =1 E���÷�Ӧ������2mol CH3OH����ų�(Q1+Q2)kJ����