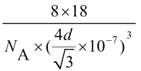题目内容
【题目】【化学——选修3:物质结构与性质】已知Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)金属铁的紧密堆积方式为_______________,其配位数为_____________________。
(2)HCN 分子的结构式为___________,与CN-互为等电子体的阴离子是_________________。
(3)K2CO3中阴离子的空间构型为_______________,CO2为_____________分子(填“极性”或“非极性”),H2O中O原子的杂化轨道类型为_______________。
(4)配合物K4Fe(CN)6的中心离子的电子排布式为__________________。
(5)上述化学方程式中C、N、O的第一电离能由小到大的顺序为________________________。
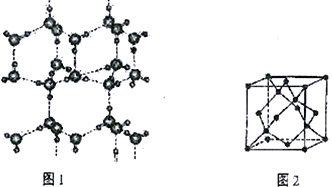
(6)冰的晶体结构模型如图1,它的晶胞与金刚石的晶胞相似,如图2,水分子之间以氢键相连接,在一个晶胞中有_____个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为___________ (用NA 表示阿伏加德罗常数的值。)
【答案】 体心立方堆积 8 H-C![]() N C22- 平面三角形 非极性 sp3杂化 1s22s22p63s23p63d6 或[Ar]3d6 C<O<N 16 ρ=
N C22- 平面三角形 非极性 sp3杂化 1s22s22p63s23p63d6 或[Ar]3d6 C<O<N 16 ρ=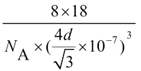
【解析】(1)金属铁的紧密堆积方式为体心立方堆积,体心Fe原子与顶点8个Fe原子相邻,其配位数为8。(2)HCN碳形成2个δ键,2个π键,HCN 分子的结构式为 H-C![]() N ,与CN-互为等电子体的阴离子是C22-。(3)K2CO3中阴离子中心原子碳形成3个δ键,孤电子对为0,空间构型为平面三角形,CO2为非极性分子,H2O中O原子有两个孤电子对,形成2个δ键,杂化轨道类型为 sp3杂化。(4)配合物K4Fe(CN)6的中心离子的电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 。(5)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,所以它们的第一电离能大小顺序是:N>O>C。(6)如图2,一个晶胞中水分子数为8×1/8+6×1/2+4=8个,晶体冰中,每两个水分子间有一个氢键,平均属于每个水分子有半个,一个水分子与周围的四个水分子以氢键结合,故1mol冰中有2 mol氢键,在一个晶胞中有8×2=16个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为 ρ=
N ,与CN-互为等电子体的阴离子是C22-。(3)K2CO3中阴离子中心原子碳形成3个δ键,孤电子对为0,空间构型为平面三角形,CO2为非极性分子,H2O中O原子有两个孤电子对,形成2个δ键,杂化轨道类型为 sp3杂化。(4)配合物K4Fe(CN)6的中心离子的电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 。(5)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,所以它们的第一电离能大小顺序是:N>O>C。(6)如图2,一个晶胞中水分子数为8×1/8+6×1/2+4=8个,晶体冰中,每两个水分子间有一个氢键,平均属于每个水分子有半个,一个水分子与周围的四个水分子以氢键结合,故1mol冰中有2 mol氢键,在一个晶胞中有8×2=16个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为 ρ=![]() =
=