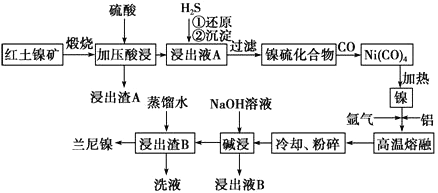
题目内容
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平),下列说法正确的是

A. 反应物微粒是S、SO32-、OH-
B. 3mol S参加反应时,转移的电子数3NA
C. 氧化剂与还原剂的物质的量之比为1:2
D. 该反应说明S2-和SO32-在碱性溶液中可以大量共存
【答案】D
【解析】
碱性条件下,S与氢氧根离子反应生成S2-和SO32-,反应的离子方程式为3S+6OH-=2S2-+SO32-+3H2O,反应中部分S的化合价从0价升高到+4价,部分S的化合价从0价降低到-2价。A.反应物微粒是S、OH-,故A错误;B.反应中3molS转移4mol电子,则2molS参加反应时,转移的电子为![]() =
=![]() mol,则电子数为
mol,则电子数为![]() NA,故B错误;C.化合价降低的硫作氧化剂,化合价升高的S作还原剂,则氧化剂与还原剂的物质的量之比为2∶1,故C错误;D.根据方程式可知,S2-和SO32-在碱性溶液中可以大量共存,故D正确;故选D。
NA,故B错误;C.化合价降低的硫作氧化剂,化合价升高的S作还原剂,则氧化剂与还原剂的物质的量之比为2∶1,故C错误;D.根据方程式可知,S2-和SO32-在碱性溶液中可以大量共存,故D正确;故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】(2018·四川省成都市第三次诊断性检测)已知H2A为二元弱酸,室温下向100.0mL0.1mol/LH2A溶液中加入不同质量的NaOH固体,pH变化如下表(不考虑溶液体积变化)。下列分析正确是
m(NaOH)/g | 0 | 0.4 | 0.8 | 1.2 |
pH | 3.8 | 8.3 | 12.0 | 13.2 |
A. H2A第一步电离K1的数量级为10-8
B. 上述过程中水的电离程度一直增大
C. m(NaOH)=0.6g时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 若溶液中加NaOH至![]() 时,c(OH-)>100c(H+)
时,c(OH-)>100c(H+)