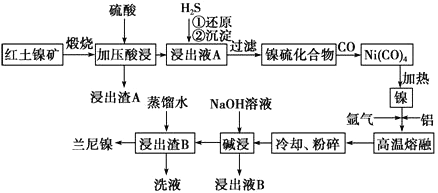
题目内容
【题目】硫是生物必须的营养元素之一,含硫化合物在自然界中广泛存在,循环关系如下图所示:
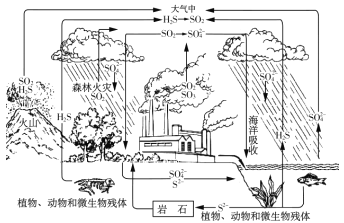
(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成 CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝( CuS), 请用化学用语表示 ZnS 转变为 CuS 的过程 __________。
(2) 火山喷发产生 H2S 在大气当中发生如下反应:
①2H2S(g)+O2(g) =2S(g) +2H2O(g) △H=﹣442.38kJ/mol
②S(g)+O2(g)=SO2(g) △ H=﹣297.04kJ/mol。
H2S(g)与 O2(g)反应产生 SO2(g)和 H2O(g)的热化学方程式是__________。
(3) 降低 SO2的排放量已经写入 2018 年政府工作报告, 化石燃料燃烧时会产生含 SO2的废气进入大气,污染环境,有多种方法可用于 SO2的脱除。
①NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收 SO2。
i.反应离子方程式是__________。
为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对 SO2的吸收。该催化过程的示意图如下图所示:
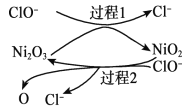
ii.过程 1 的离子方程式是__________。
iii.Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,原因是__________。
②电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2还可以制得 H2SO4。
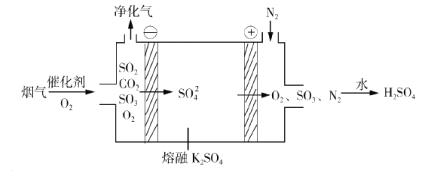
i.在阴极放电的物质是______。
ii.在阳极生成 SO3的电极反应式是______。
【答案】 2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=﹣1036.46kJ/mol ZnS(s) +Cu2+ (aq)![]() Zn2+(aq)+CuS ClO-+SO2+2OH- ===Cl-+SO42-+H2O Ni2O3+ClO- ===2NiO2 +Cl- Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行 O2 SO2 - 2e- +SO42-= 2SO3
Zn2+(aq)+CuS ClO-+SO2+2OH- ===Cl-+SO42-+H2O Ni2O3+ClO- ===2NiO2 +Cl- Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行 O2 SO2 - 2e- +SO42-= 2SO3
【解析】(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成 CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝(CuS), ZnS 转变为 CuS 的化学方程式为ZnS(s) +Cu2+ (aq)![]() Zn2+(aq)+CuS。
Zn2+(aq)+CuS。
(2) 已知:①2H2S(g)+O2(g) =2S(g) +2H2O(g) △H=﹣442.38kJ/mol;②S(g)+O2(g)=SO2(g) △ H=﹣297.04kJ/mol。根据盖斯定律,由①+②![]() 2可得2H2S(g)+3O2(g)=2SO2(g)+2H2O(g),故△H=(﹣442.38kJ/mol)+(﹣297.04kJ/mol)
2可得2H2S(g)+3O2(g)=2SO2(g)+2H2O(g),故△H=(﹣442.38kJ/mol)+(﹣297.04kJ/mol)![]() 2=﹣1036.46kJ/mol,所以,H2S(g)与O2(g)反应产生SO2(g)和 H2O(g)的热化学方程式是2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=﹣1036.46kJ/mol。
2=﹣1036.46kJ/mol,所以,H2S(g)与O2(g)反应产生SO2(g)和 H2O(g)的热化学方程式是2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H=﹣1036.46kJ/mol。
(3)①NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收SO2. NaClO 碱性具有强氧化性,可以把SO2氧化为SO42-。i.反应离子方程式是ClO-+SO2+2OH- ===Cl-+SO42-+H2O。由催化过程的示意图可知,过程1中, Ni2O3与ClO- 反应生成具有强氧化性的NiO2 ,过程2中,NiO2与ClO-反应生成具有强氧化性的O原子。ii.过程 1 的离子方程式是Ni2O3+ClO- ===2NiO2 +Cl-。iii.Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,原因是Ca2+与SO42-结合生成微溶的CaSO4有利于反应的进行。
②由电化学脱硫法装置示意图可知,该装置为电解池,烟气经催化氧化后,部分二氧化硫被氧化为三氧化硫,所得气体通入该装置,在阴极上,氧气得到电子被还原为硫酸根离子,电极反应式为O2+4e- + 2SO3= 2SO42-;在阳极上,二氧化硫失去电子被氧化为三氧化硫,电极反应式为2SO2 - 4e- +2SO42-= 4SO3,三氧化硫经氮气导出与水反应生成硫酸,这样,不仅可脱除烟气中的SO2还可以制得 H2SO4。i.在阴极放电的物质是O2。ii.在阳极生成 SO3的电极反应式是SO2 - 2e- +SO42-= 2SO3。