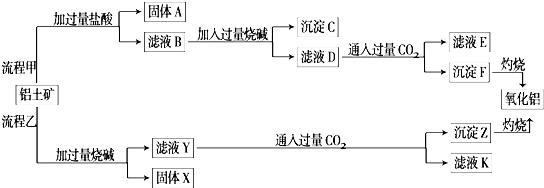
题目内容
14.为确定某酸HA是弱电解质,两同学的实验方案如下:甲:①称取一定质量的HA,配制0.1mol•L-1的溶液100mL;
②用pH计测出该溶液的pH,根据pH=-lg c(H+),推算出溶液中H+的浓度,即可证明HA是弱电解质.
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制0.1mol•L-1的两种酸溶液各100mL;
②分别取配制的这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质.
(1)在两个方案的第①步中,都要用到的定量仪器是100 mL容量瓶.
(2)甲方案中说明HA是弱电解质的理由是测得溶液的H+的浓度<0.1mol•L-1 (选填“>”、“<”或“=”).
(3)乙方案中说明HA是弱电解质的现象是A.
A.装盐酸的试管中放出气体的速率快;
B.装HA溶液的试管中放出气体的速率快;
C.两个试管中产生气体的速率一样快.
(4)请你评价:乙方案中的不妥之处:加入的锌粒质量应相同,难以做到锌的表面积相同.
(5)已知在T°C时,0.1mol•L-1HA溶液中HA的电离度为5%,求该温度下HA的电离常数(写出计算过程)2.63×10-4.
分析 (1)配制一定浓度的溶液必须使用的仪器是容量瓶;
(2)弱电解质的电离是可逆的,不能完全电离;
(3)等浓度的一元强酸和一元弱酸中,强酸中的氢离子浓度大于弱酸;
(4)加入的金属的质量应该相同,且加入的锌粒表面积难以做到相同;
(5)溶液中c(H+)=c(A-),c(HA)=c(HA)-c(H+),根据Ka=$\frac{c({H}^{+})×c({A}^{-})}{c(HA)}$计算.
解答 解:(1)在两个方案的第①步中,配制0.1mol/L的溶液100mL、别配制pH=1的两种酸溶液各100mL,根据配制一定浓度的溶液必须使用容量瓶,
故答案为:100mL容量瓶;
(2)配制0.1mol/L的HA酸溶液100mL,弱电解质的电离是可逆的,不能完全电离,测得溶液的H+的浓度<0.1mol•L-1,
故答案为:<;
(3)各取相同体积、浓度的两种酸溶液装入两个试管,同时加入纯度相同的锌粒,由于盐酸完全电离,盐酸中氢离子的浓度大,反应速率快,则装盐酸溶液的试管中放出H2的速率快,所以A正确,
故答案为:A;
(4)加入的金属的质量应该相同,又因为固体的表面积也影响反应速率,因此不妥之处在于加入的锌粒表面积难以做到相同,
故答案为:加入的锌粒质量应相同;难以做到锌的表面积相同;
(5)溶液中c(H+)=c(A-)=0.1mol•L-1×5%=5×10-3 mol/L,
c(HA)=c(HA)-c(H+)=9.5×10-2 mol/L,
则Ka=$\frac{c({H}^{+})×c({A}^{-})}{c(HA)}$=$\frac{(5×1{0}^{-5})^{2}}{9.5×1{0}^{-2}}$=2.63×10-4 mol/L;
故答案为:2.63×10-4.
点评 本题考查了探究弱电解质的方法,试题难度中等,注意掌握强电解质与弱电解质的区别,注意把握电离平衡常数的计算方法,该题有利于培养学生严谨的逻辑思维能力,提高学生的学习效率,激发学生的学习兴趣.

| A. | 油脂在酸性条件下水解的反应称为皂化反应 | |
| B. | 煤的炼制方法中煤的气化和液化是物理方法,煤的干馏是化学方法 | |
| C. | 石油裂化的目的是提高轻质油的产量和质量 | |
| D. | 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 |

| A. | Y的原子半径在同周期主族元素中最大 | |
| B. | W的非金属性比Z的弱 | |
| C. | Z的气态氢化物的稳定性在同主族元素中最强 | |
| D. | W的最高价氧化物对应的水化物是强酸 |
| A. | 只要使用合理的催化剂及载体,就可完全清除NO和CO | |
| B. | 使用催化剂只能改变反应的速率不能改变反应的平衡常数 | |
| C. | 假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO) | |
| D. | 恒容条件下,通入惰性气体可提高NO转化率 |
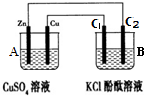 思考下列问题,按要求填空:
思考下列问题,按要求填空:(1)某温度下纯水中c(H+)=2×10-7mol/L,①此时溶液中的c(OH-)=2×10-7mol/L.
②若温度不变,向水中滴入稀盐酸使c(H+)=5×10-6mol/L,则此时溶液中的c(OH-)=8×10-9mol/L
(2)已知下列热化学方程式:Zn(s)+21 O2(g)═ZnO(s)△H1=-351.1kJ•mol-1;
Hg(l)+21 O2(g)═HgO(s)△H2=-90.7kJ•mol-1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变为-260.4kJ/mol
(3)在稀氨水中存在下述电离平衡NH3+H2O?NH3•H2O?NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向”、“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | 减小 | 减小 | 增大 |
| 平衡移动方向 | 逆向 | 正向 | 逆向 |
①判断装置的名称:A池为原电池.
②锌极为负极,电极反应式为Zn-2e-=Zn2+;
③当C2极析出224mL气体(标准状况下),锌的质量减少_0.65_g.
| A. | Q=92 kJ | B. | Q<92 kJ | C. | Q>92 kJ | D. | Q=194kJ |
| A. |  | B. |  | C. |  | D. |  |
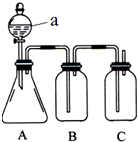 某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱.供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液