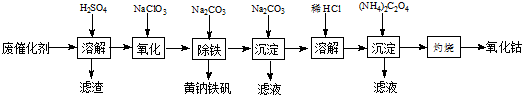
题目内容
9. 思考下列问题,按要求填空:
思考下列问题,按要求填空:(1)某温度下纯水中c(H+)=2×10-7mol/L,①此时溶液中的c(OH-)=2×10-7mol/L.
②若温度不变,向水中滴入稀盐酸使c(H+)=5×10-6mol/L,则此时溶液中的c(OH-)=8×10-9mol/L
(2)已知下列热化学方程式:Zn(s)+21 O2(g)═ZnO(s)△H1=-351.1kJ•mol-1;
Hg(l)+21 O2(g)═HgO(s)△H2=-90.7kJ•mol-1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变为-260.4kJ/mol
(3)在稀氨水中存在下述电离平衡NH3+H2O?NH3•H2O?NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何?(填“正向”、“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | 减小 | 减小 | 增大 |
| 平衡移动方向 | 逆向 | 正向 | 逆向 |
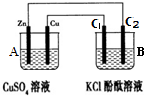
①判断装置的名称:A池为原电池.
②锌极为负极,电极反应式为Zn-2e-=Zn2+;
③当C2极析出224mL气体(标准状况下),锌的质量减少_0.65_g.
分析 (1)①依据纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同;②在酸溶液、碱溶液、盐溶液中存在离子积常数,Kw随温度变化;
(2)根据盖斯定律,利用已知的热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减,据此计算;
(3)在稀氨水中存在下述电离平衡NH3+H2O?NH3•H2O?NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”、“减小”或“不变”);平衡移动方向如何;
(4)①该装置中,A能自发的进行氧化还原反应,所以构成原电池,锌易失电子作负极、C作正极,锌电极反应式为Zn-2e-=Zn2+,C电极反应式为Cu2++2e-=Cu;
②锌易失电子作负极、C作正极,锌电极反应式为Zn-2e-=Zn2+;
③根据串联电路中转移电子相等计算.
解答 解:(1)①某温度下纯水中的C(H+)=2×10-7mol/L,则此时溶液中的C(OH-)=2×10-7mol/L;②若温度不变,滴入稀盐酸,使C(H+)=5×10-6mol/L,溶液中则溶液中C(H+)C(OH-)=4×10-14,所以C(OH-)=8×10-9 mol/L,故答案为:①2×10-7 mol/L; ②8×10-9 mol/L;
(2)已知下列热化学方程式:
①2Zn(s)+O2(g)=2ZnO(s);△H1=-702.2kJ/mol,
②2Hg(l)+O2(g)=2HgO(s);△H2=-181.4kJ/mol,
根据盖斯定律可知:$\frac{①-②}{2}$得热化学方程式Zn(s)+HgO(s)=ZnO(s)+Hg(l),
则△H=$\frac{-702.2kJ/mol+181.4kJ/mol}{2}$=-260.4kJ/mol,故答案为:-260.4kJ/mol;
(3)氨水中存在NH3+H2O?NH3•H2O?NH4++OH-,向氨水中加入少量硫酸铵,硫酸铵中含量铵根离子,导致溶液中铵根离子浓度增大,抑制氨水电离,平衡向左移动,所以溶液中氢氧根离子浓度减小;
向氨水中加入少量硝酸,氢离子和氢氧根离子反应,导致氢氧根离子浓度减小,促进氨水电离,平衡向右移动;
向氨水中加入少量氢氧化钾,导致氢氧根离子浓度增大,抑制氨水电离,平衡向左移动,
故答案为:
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | 减小 | 增大 | |
| 平衡移动方向 | 正向 |
(4)①该装置中,A能自发的进行氧化还原反应,所以构成原电池,故答案为:原电池;
②锌易失电子作负极、C作正极,锌电极反应式为Zn-2e-=Zn2+,故答案为:负,Zn-2e-=Zn2+;
③C1、C2分别是阳极、阴极,C1、C2电极反应式分别为2Cl--2e-=Cl2↑、2H2O+2e-=H2↑+2OH-而锌电极反应式为Zn-2e-=Zn2+,所以H2↑~Zn,所以C2极析出224mL气体,消耗锌的质量为:0.65g,故答案为:0.65.
点评 本题考查弱电解质电离,加入相同的离子则抑制弱电解质电离,加入和溶液中离子反应的物质则促进其电离,原电池和电解池原理,正确判断原电池和电解池是解本题关键,再结合各个电极上发生的反应分析解答,难度不大

| A. | Na的原子结构示意图: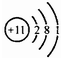 | B. | N2分子的结构式:N=N | ||
| C. | HC1的电子式: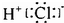 | D. | H2O分子的球棍模型: |
| A. | 通入CH4 的电极为正极 | |
| B. | 正极的电极反应式为:2O2+8e-+4H2O═8OH- | |
| C. | 若甲烷通入量为1.12 L(标准状况)且反应完全,则电池中有0.1 mol O2 被氧化 | |
| D. | 通入甲烷的电极的电极反应式为:CH4+2O2+4e-═CO2+2H2O |
| A. | 容器内气体混合物的密度不随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| C. | 单位时间内消耗0.1mol X,同时生成0.2mol Y | |
| D. | 单位时间内消耗0.1mol X,同时生成0.2mol Z |
| A. | 正极反应:O2+2H2O+4e-═4OH- | |
| B. | 当正极消耗22.4 L H2时,负极11.2 L O2消耗(相同条件) | |
| C. | 发生氧化反应的是负极 | |
| D. | 氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
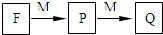 短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色.
短周期主族元素A、B、C、D、E、F的原子序数依次增大.A和B形成4个原子核的分子,A和C形成3个原子核的分子,且两种分子均含有10个电子.D的阳离子的电子层结构与氖相同,且与A同主族.E的常见氧化物有两种,其中一种能使品红溶液褪色.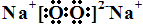 .
. .
. .
.