��Ŀ����
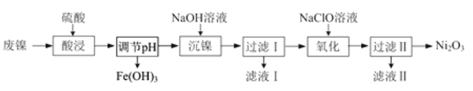
����Ŀ���ۺ���������������������ˮ����ij���������Է����������Ͻ�Ϊԭ���Ʊ��ۺ�����������������ƻ����������£�
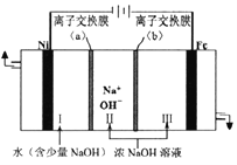
��֪���ۺ�������������ˮ�������Ҵ����仯ѧʽ�ɱ�ʾΪ[Fe2(OH)x(SO4)y]n��
(1)�ھۺ��������У�x��y֮��Ĺ�ϵ��_______________���Լ�X�����ʵĻ�ѧʽΪ______��
(2)д����������ͼ�е��������������ӷ���ʽ��______________����ƴ���ȱ�ݣ�������Ľ������________
(3)�����Լ�Y��Ŀ����Ϊ�˵�����Һ��pH����YΪ�����д������pH�����ӷ���ʽ��_____
(4)��֪������Fe(OH)3��Mg(OH)2��Ksp�ֱ�Ϊ8.0��10-38��1.0��10-11����Ũ�Ⱦ�Ϊ0.1mol/L��FeCl3��MgCl2 �Ļ����Һ�м����Һ��ҪʹFe3+ �պ���ȫ������pHΪ____����Mg2+�պÿ�ʼҪ������pHΪ__________������֪lg 2=0.3��
���𰸡�x+2y=6 KOH 3Fe2+ +4H+ + NO3�� == 3Fe3+ + NO �� +2H2O ��ϡ�����Ϊ˫��ˮ��ͨ������ Fe2O3+6H+��2Fe3++3H2O 3.3 9
��������
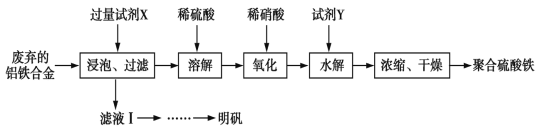
�����̿�֪�������������Ͻ��������������Һ���ݣ�����Ӧ�õ�ƫ�������Һ�����˺���Һ��һϵ�в�����Ӧ�����������أ������м���ϡ�����������Ӧ������������������ϡ��������Ϊ�������������Լ�Y������Һ��pHֵ�������������µ����ʣ��������������ᷴӦ��������Һ��pHֵ������Խǿ����������ˮ��̶�����Խ��������������Խ�٣��õ���Һͨ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�������Եõ��ۺ���������
(1) ���ݻ��ϼ۵Ĵ�����Ϊ��������㣻����������ǿ�Ӧ��������ǿ�Ӧ����������Լ�X��
(2) ����ͼ�е����������Ĺ��������ὫFe2+����ΪFe3+�Ĺ��̣��ݴ���д���ӷ���ʽ�����ܹ����������ʵĽǶȷ������ڵ�ȱ�ݣ�
(3)���������������ᷴӦ������Һ��pH���������µ����ʣ��ɴ���д���ӷ���ʽ��
(4)����Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)��Ksp[Mg(OH)2]=c(Mg2+)c2(OH-)�����c(OH-)��һ������pH��
(1) ���ݻ��ϼ۵Ĵ�����Ϊ���֪(+3)��2+(-1)��x+(-2)��y=0����˿ɵ�x��y֮��Ĺ�ϵΪx+2y=6��������ǿ�Ӧ��������ǿ�Ӧ���ٽ�ϲ����������ʵ�ԭ��֪������Լ�XΪKOH��
(2) ����ͼ�е����������Ĺ��������ὫFe2+����ΪFe3+�Ĺ��̣����ӷ���ʽΪ��3Fe2+ +4H+ + NO3- = 3Fe3+ + NO �� +2H2O�����������������м���ϡ���ᣬ�������µ����ʣ��ɽ�ϡ�����Ϊ˫��ˮ��ͨ��������
(3) ���������������ᷴӦ������Һ��pH���������µ����ʣ�������ӷ���ʽΪ��Fe2O3+6H+��2Fe3++3H2O��
(4) ��Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)����ôc(OH-)=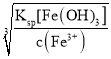 =
=![]() =2��10-13��
=2��10-13��![]() mol/L����Ksp[Mg(OH)2]=c(Mg2+)c2(OH-)����ôc(OH-)=
mol/L����Ksp[Mg(OH)2]=c(Mg2+)c2(OH-)����ôc(OH-)=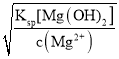 =
=![]() =1.0��10-5mol/L����ʱ��ҪʹFe3+ �պ���ȫ������c(OH-)=2��10-13��
=1.0��10-5mol/L����ʱ��ҪʹFe3+ �պ���ȫ������c(OH-)=2��10-13��![]() mol/L����ôc(H+)=
mol/L����ôc(H+)=![]() ����ʱ��Һ��pH=3.3��Mg2+�պÿ�ʼҪ������c(OH-)=1.0��10-5mol/L����ôc(H+)=
����ʱ��Һ��pH=3.3��Mg2+�պÿ�ʼҪ������c(OH-)=1.0��10-5mol/L����ôc(H+)=![]() =10-9mol/L����ʱpH=9��
=10-9mol/L����ʱpH=9��

 �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д� Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�����Ŀ���Ȱ�����������������Ӧ���ɵ�һ�����dz��õ�����ˮ��������������Ҫ����һ�Ȱ������Ȱ������Ȱ�(NH2Cl��NHCl2��NCl3)����������������ˮ���������ش��������⣺
(1)��һ�Ȱ�(NH2Cl)�ĵ���ʽΪ ________________ ��
�ڹ�ҵ�Ͽ����÷�ӦCl2(g)+NH3(g)=NH2Cl(g)+HCl(g)�Ʊ�һ�Ȱ�����֪���ֻ�ѧ���ļ������±���ʾ�����費ͬ������ͬ�ֻ�ѧ���ļ�����ͬ������÷�Ӧ����H=________��
��ѧ�� | N-H | Cl-Cl | N-Cl | H-Cl |
����(kJ/mol) | 391 | 243 | 191 | 431 |
��һ�Ȱ�����Ҫ��ˮ����������ԭ��������һ�Ȱ������ԡ����Ի����лᷢ��ˮ�⣬���ɾ���ǿ��ɱ���������õ����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________��
(2)��Cl2��NH3��Ӧ�Ʊ����Ȱ��ķ���ʽΪ2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g)�����ݻ���Ϊ1 L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T��)�����зֱ����2 mol Cl2��2 mol NH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
NHCl2(l)+2HCl(g)�����ݻ���Ϊ1 L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T��)�����зֱ����2 mol Cl2��2 mol NH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(������)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (��������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�ټ������У�0��40 min����NH3��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(NH3)=___________��
�ڸ÷�Ӧ����H________0(����>������<��) ��
�۶Ը÷�Ӧ������˵����ȷ����______________(��ѡ����ĸ����
A���������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬
B����������Cl2��NH3���ʵ���֮�Ȳ��䣬�������Ӧ�ﵽƽ��״̬
C����Ӧ�ﵽƽ��������������䣬��ԭ�����г���һ����������Cl2��ת��������
D����Ӧ�ﵽƽ��������������䣬����һ������NHCl2��ƽ�����淴Ӧ�����ƶ�
(3)�ں��������£�2molCl2��1molNH3������Ӧ2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g)�����ƽ��ʱCl2��HCl�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
NHCl2(l)+2HCl(g)�����ƽ��ʱCl2��HCl�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��

��A��B��C������Cl2ת������ߵ���______��(����A����B������C��)��(��ʾ��C��ʱHCl��Cl2��Ũ�����)
�ڼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=_________(Kp��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)