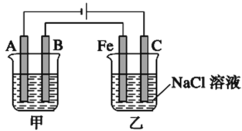
题目内容
【题目】光气(COCl2)的分解反应为:COCl2(g)![]() Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):

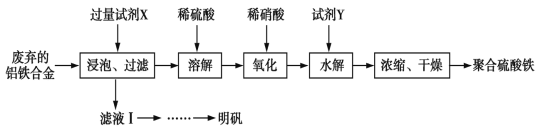
(1)计算反应在第8min时的平衡常数K=__;
(2)比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)__T(8)(填“<”、“>”或“=”);
(3)若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=__mol·L-1;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小__;
(5)比较反应物COCl2在5~6min和15~16min时平均反应速率的大小:v(5~6)__v(15~16)(填“<”、“>”或“=”),原因是__。
【答案】0.234 < 0.031 v(5~6)>v(2~3)=v(12~13) > 在相同温度时,该反应的反应物浓度越高,反应速率越大
【解析】
本题考查![]() 图像,及平衡常数,反应速率的计算;
图像,及平衡常数,反应速率的计算;![]() 反应处于平衡状态,
反应处于平衡状态,![]() 平衡正向移动,
平衡正向移动,![]() 再次到达平衡,
再次到达平衡,![]() 移走生成物一氧化碳,使平衡再次正向进行,在
移走生成物一氧化碳,使平衡再次正向进行,在![]() 达到平衡,
达到平衡,![]() 再次改变某一条件使平衡正向移动,最终达到平衡。
再次改变某一条件使平衡正向移动,最终达到平衡。
(1)由图可知,![]() 时
时![]() 的平衡浓度为
的平衡浓度为![]() ,
,![]() 的平衡浓度为
的平衡浓度为![]()
![]() 的平衡浓度为
的平衡浓度为![]() ,故该温度下的化学平衡常数
,故该温度下的化学平衡常数![]() ;
;
故答案为:0.234;
(2)第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡正向移动,4min瞬间浓度不变,不可能为改变压强、浓度,正向移动,向吸热方向移动,故T(2) <T(8);
故答案为:<;
(3)由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算![]() ,解得
,解得![]() ;
;
故答案为:0.031;
(4)已知![]() ,结合图像可知,v(5~6)>v(2~3)=v(12~13);
,结合图像可知,v(5~6)>v(2~3)=v(12~13);
故答案为:v(5~6)>v(2~3)=v(12~13);
(5)在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小;
故答案为:> ;在相同温度时,该反应的反应物浓度越高,反应速率越大。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案