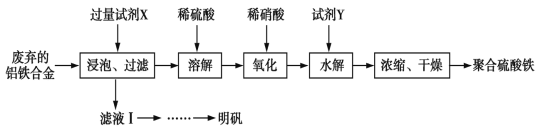
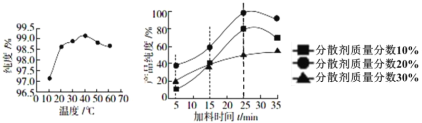
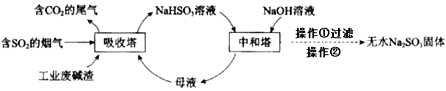
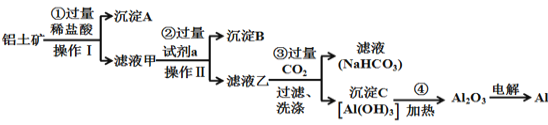
题目内容
【题目】以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
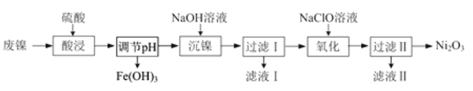
(1)“酸浸”时为了提高酸浸的速率(浸取率),可采取的措施有_____________(任写出一条)。
(2)“酸浸”时Fe2O3发生反应的离子方程式:____________________________________。
(3)“调节pH”使溶液中的Fe3+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于__________ [已知Fe(OH)3的Ksp=4×10-38,![]() ≈1.6 ]。
≈1.6 ]。
(4)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是_____________________________________。
(5)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:____________________。
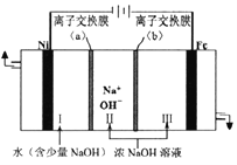
(6)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的![]() 。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
。电解时阳极的电极反应式为___________________________________,离子交换膜(b)为______(填“阴”或“阳”)离子交换膜。
【答案】粉碎或加热或搅拌 或适当增大硫酸浓度 Fe2O3 + 6H+ = 2Fe3+ + 3H2O 1.6×10-11 静置,在上层清液中继续滴加NaOH溶液,无沉淀生成 2Ni(OH)2+ClO-==Ni2O3+Cl-+2H2O Fe-6e-+8OH-==FeO42-+4H2O 阴
【解析】
(1)“酸浸”时为了提高酸浸的速率(浸取率),可采取增大浓度、升高温度、增大接触面积等措施。
(2)“酸浸”时Fe2O3与H+反应,生成Fe3+和水。
(3)c(Fe3+)≤10-5 mol·L-1,利用Ksp[Fe(OH)3]= c(Fe3+)c3(OH-)=4×10-38,即可求出c(OH-)。
(4)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是再加碱,看是否有沉淀生成。
(5)“滤液Ⅱ”所含阴离子主要为Cl-,则“氧化”时发生的反应是Ni(OH)2与ClO-反应,生成Ni2O3、Cl-等。
(6)通电后,在铁电极附近生成紫红色的![]() ,则电解时阳极反应为Fe在碱性环境中失电子,生成
,则电解时阳极反应为Fe在碱性环境中失电子,生成![]() 等,由于反应需要消耗OH-,所以离子交换膜(b)应允许OH-通过。
等,由于反应需要消耗OH-,所以离子交换膜(b)应允许OH-通过。
(1)“酸浸”时为了提高酸浸的速率(浸取率),可从增大浓度、升高温度、增大接触面积等方面考虑,即可采取的措施是粉碎(或加热,搅拌,适当增大硫酸浓度等)。答案为:粉碎 或 加热 或 搅拌或 适当增大硫酸浓度;
(2)“酸浸”时Fe2O3与H2SO4发生复分解反应,离子方程式为Fe2O3 + 6H+ = 2Fe3+ + 3H2O。答案为:Fe2O3 + 6H+ = 2Fe3+ + 3H2O;
(3)c(Fe3+)≤10-5 mol·L-1,利用Ksp[Fe(OH)3]= c(Fe3+)c3(OH-)=4×10-38,将c(Fe3+)代入,即可求出c(OH-)≥![]() ×10-11mol/L=1.6×10-11。答案为:1.6×10-11;
×10-11mol/L=1.6×10-11。答案为:1.6×10-11;
(4)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是静置,在上层清液中继续滴加NaOH溶液,无沉淀生成。答案为:静置,在上层清液中继续滴加NaOH溶液,无沉淀生成;
(5)“滤液Ⅱ”所含阴离子主要为Cl-,则“氧化”时发生的反应是Ni(OH)2与ClO-反应,生成Ni2O3、Cl-等,反应的离子方程式为2Ni(OH)2+ClO-==Ni2O3+Cl-+2H2O。答案为:2Ni(OH)2+ClO-==Ni2O3+Cl-+2H2O;
(6)通电后,在铁电极附近生成紫红色的![]() ,则电解时阳极反应为Fe在碱性环境中失电子,生成
,则电解时阳极反应为Fe在碱性环境中失电子,生成![]() 等,电极反应式为Fe-6e-+8OH-==FeO42-+4H2O;由于反应需要消耗OH-,所以离子交换膜(b)应允许OH-通过,为阴离子交换膜。答案为:Fe-6e-+8OH-==FeO42-+4H2O;阴。
等,电极反应式为Fe-6e-+8OH-==FeO42-+4H2O;由于反应需要消耗OH-,所以离子交换膜(b)应允许OH-通过,为阴离子交换膜。答案为:Fe-6e-+8OH-==FeO42-+4H2O;阴。

【题目】碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
I.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法。将样品放入圆底烧瓶中:
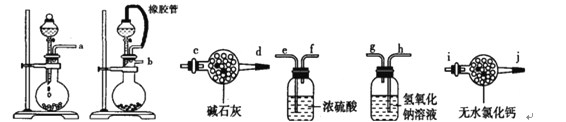
(1)请选择必要地装置,按气流方向连接顺序为________________。
(2)分液漏斗中的液体最适合的是___________。
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用____________________________________。
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量。甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4 +2H2SO4 + 6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量。步骤如下:
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液。用________准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴________指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 1.20 | 16.21 |
2 | 3.00 | 18.90 |
3 | 4.50 | 19.49 |
达滴定终点时的现象为______________________________,由此可计算出该样品中的氮的质量分数为_________________。
(5)在滴定实验结束后发现滴定用的滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值________(填“偏大”“偏小”或“无影响”)。