题目内容
【题目】氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3),副产物少于其它水消毒剂。回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为 ________________ 。
②工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(g)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的△H=________。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391 | 243 | 191 | 431 |
③一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌消毒作用的物质,该反应的化学方程式为_________________________________。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40 min内用NH3的浓度变化表示的平均反应速率v(NH3)=___________。
②该反应的△H________0(填“>”或“<”) 。
③对该反应,下列说法正确的是______________(填选项字母)。
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

①A、B、C三点中Cl2转化率最高的是______点(填“A”“B”或“C”)。(提示:C点时HCl和Cl2的浓度相等)
②计算C点时该反应的压强平衡常数Kp(C)=_________(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
【答案】![]() +12 kJ/mol NH2Cl +H2O
+12 kJ/mol NH2Cl +H2O ![]() HClO +NH3 6.25×10-3 mol/(L.min) < AB B 0.5 (M Pa)-1
HClO +NH3 6.25×10-3 mol/(L.min) < AB B 0.5 (M Pa)-1
【解析】
(1) ①一氯胺是共价化合物,N原子与H原子、Cl原子之间形成1对共用电子对;
②一氯胺为共价化合物,发生反应Cl2(g)+NH3(g)=NH2Cl(g)+HCl(g),根据△H=反应物的总键能-生成物的总键能进行计算;
③一氯胺是重要的水消毒剂,在中性、酸性环境中发生水解反应生成NH3和HClO;
(2) ①根据v=![]() 进行计算;
进行计算;
②根据数据可知,甲容器达到平衡时,用时120min,乙容器达到平衡时,用时80min,说明乙容器的反应速率大于甲容器的反应速率,说明乙容器的温度高于甲容器中的温度,且甲容器中剩余的Cl2多余乙容器中剩余的Cl2,Cl2增多,说明升高温度,平衡逆向进行;
③可逆反应达到平衡时,正反应速率等于逆反应速率,各组分的浓度、含量等保持不变,由此衍生出的其它的一些量不变;
(3) ①反应前后气体的体积减小,生成HCl越多,Cl2转化率越大;
②C点HCl和Cl2浓度相同,结合三段法列式可计算得到平衡状态下各物质的物质的量, 再计算物质的量分数,最后根据Kp=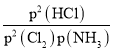 进行计算。
进行计算。
(1) ①一氯胺是共价化合物,N原子与H原子、Cl原子之间形成1对共用电子对,其电子式为:![]() ;
;
②△H=反应物的总键能-生成物的总键能=(3×391+243)-(2×391+191+431)=+12 kJ/mol;
③一氯胺是重要的水消毒剂,在中性、酸性环境中发生水解反应生成NH3和HClO,反应方程式为:NH2Cl +H2O ![]() HClO +NH3;
HClO +NH3;
(2) ①甲容器中,0~40 min内氯气的物质的量的变化量为2.00mik-1.50mol=0.50mol,变化量之比等于化学计量数之比,因此氨气的物质的量的变化量为![]() =0.25mol,浓度的变化量为
=0.25mol,浓度的变化量为![]() =0.25mol/L,因此v=
=0.25mol/L,因此v=![]() =
=![]() =0.00625mol/(Lmin);
=0.00625mol/(Lmin);
②根据数据可知,甲容器达到平衡时,用时120min,乙容器达到平衡时,用时80min,说明乙容器的反应速率大于甲容器的反应速率,说明一容器的温度高于甲容器中的温度,且甲容器中剩余的Cl2多余乙容器中剩余的Cl2,Cl2增多,说明升高温度,平衡逆向进行,进一步说明该反应正向为放热反应,即△H<0;
③A. 由反应的方程式可知,该反应气体的质量发生变化,气体体积不变,当容器内气体的密度不变时,证明达到了平衡状态,A项正确;
B. 若容器内Cl2和NH3物质的量之比不变,说明容器内物质的浓度不发生变化,说明反应达到了平衡状态,B项正确;
C. 反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,各物质的浓度不发生变化,平衡不移动,Cl2的转化率不变,C项错误;
D. 反应达到平衡后,其他条件不变,加入一定量的NHCl2,因NHCl2为液态,增大液体的量,平衡不移动,D项错误;
正确的选AB;
(3) ①反应前后气体的体积减小,由图象可知三点中B点HCl最多,因此B点Cl2转化率最高;
②设反应掉的NH3的物质的量为xmol,那么
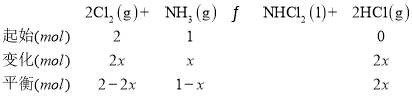
2-2x=2x,解得x=0.5mol,总物质的量为3-3x+2x=3-x=3-0.5=2.5mol,总压强为10MPa,因此Kp(C)=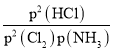 =
= =0.5MPa。
=0.5MPa。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案【题目】氮是一种重要的元素,可用来合成NH3与 HNO3等一系列重要化工产品。
(1)在标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.9g/mL,则该氨水的物质的量浓度是_______(小数点后保留一位)。
(2)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C + O2 → 2CO ②C + H2O(g) → CO + H2 ③CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
则计算参加反应的H2O(g)和氧气的体积比V(H2O)/V(氧气)=__________上表中x=________m3,实际消耗了___________ kg焦炭。
(3)工业生产硝酸时尾气必须充分处理以避免环境污染,常用NaOH溶液吸收,吸收时发生反应:
①2NO2 + 2NaOH→NaNO3 + NaNO2 + H2O
②NO + NO2 + 2NaOH→2NaNO2 + H2O
现将22.4升(标准状况)NOx(只含NO、NO2,忽略其它成分)气体缓缓通入足量NaOH溶液中,充分反应,气体全部被吸收。则反应中产生NaNO3和NaNO2各多少克?(用含x的代数式表示)____________________
【题目】碳酸氢铵是我国主要的氮肥品种之一,在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
I.某学生设计了一套以测定二氧化碳含量间接测定含氮量的方法。将样品放入圆底烧瓶中:
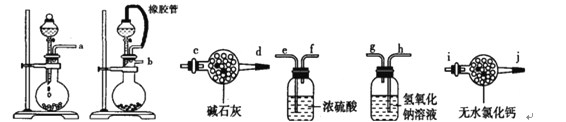
(1)请选择必要地装置,按气流方向连接顺序为________________。
(2)分液漏斗中的液体最适合的是___________。
A.稀盐酸 B.稀硫酸 C.浓硝酸 D.氢氧化钠
(3)连在最后的装置起到的作用____________________________________。
Ⅱ.如果氮肥中成分是(NH4)2SO4,则可以用甲醛法测定含氮量。甲醛法是基于甲醛与一定量的铵盐作用,生成相当量的酸,反应为2(NH4)2SO4+6HCHO→(CH2)6N4 +2H2SO4 + 6H2O,生成的酸再用氢氧化钠标准溶液滴定,从而测定氮的含量。步骤如下:
(4)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液。用________准确取出20.00mL的溶液于锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴________指示剂(已知滴定终点的pH约为8.8),用浓度为0.08mol/L氢氧化钠标准溶液滴定,读数如下表:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 1.20 | 16.21 |
2 | 3.00 | 18.90 |
3 | 4.50 | 19.49 |
达滴定终点时的现象为______________________________,由此可计算出该样品中的氮的质量分数为_________________。
(5)在滴定实验结束后发现滴定用的滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值________(填“偏大”“偏小”或“无影响”)。