题目内容
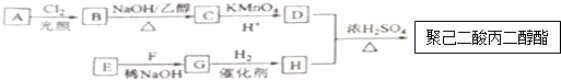
20.
④R$\stackrel{{\;}_{1}}{\;}$CHO+R2CH2CHO$\stackrel{稀NaOH}{→}$
 $\stackrel{△}{→}$
$\stackrel{△}{→}$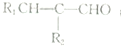
⑤R1-CH═CH-R2$\stackrel{KMnO_{4}(H+)}{→}$R1-COOH+R2-COOH
回答下列问题:
(1)A的结构简式为
 .
.(2)由E和F生成G的反应类型为加成反应,G的化学名称为3-羟基丙醛.
(3)①由D和H生成聚己二酸丙二醇醋的化学方程式为n HOOC(CH2)4COOH+n HOCH2CH2CH2OH$→_{△}^{浓硫酸}$
 +(2n-1)H2O.
+(2n-1)H2O.②若聚己二酸丙二醇酯平均相对分子质量为5600,则其平均聚合度约为a(填标号).
a.30 b.35 c.40 d.48
(4)D的同分异构体中能同时满足下列条件的共有12 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体;
②既能发生银镜反应,又能发生水解反应.
其中核磁共振氧谱显示为4组峰,且蜂面积比为6:1:1:2的是
 (写出其中一种结构简式).
(写出其中一种结构简式).(5)请设计以甲苯、乙醛为有机原料(其他无机原料任选)合成肉桂酸
(
 )的合成路线示意图(不能超过5步).
)的合成路线示意图(不能超过5步).已知:
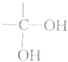 →
→ +H2O
+H2O示例:H2C═CH2$→_{催化剂,△}^{H_{2}O}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOC2H3.
分析 根据聚己二酸丙二醇酯( )的结构简式可知,D、H应为HOOC(CH2)4COOH和HOCH2CH2CH2OH,D是C被高锰酸钾氧化的产物,H是G被氢气还原的产物,所以D为HOOC(CH2)4COOH,H为HOCH2CH2CH2OH,根据题中转化关系可推得,A发生光照下取代反应生成一氯代烃B,B发生消去反应生成C,C发生氧化反应生成D,G与氢气发生加成反应生成H,信息④可知E与F反应生成G,所以可以确定,A的结构简式为
)的结构简式可知,D、H应为HOOC(CH2)4COOH和HOCH2CH2CH2OH,D是C被高锰酸钾氧化的产物,H是G被氢气还原的产物,所以D为HOOC(CH2)4COOH,H为HOCH2CH2CH2OH,根据题中转化关系可推得,A发生光照下取代反应生成一氯代烃B,B发生消去反应生成C,C发生氧化反应生成D,G与氢气发生加成反应生成H,信息④可知E与F反应生成G,所以可以确定,A的结构简式为 ,B为
,B为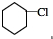 ,C为
,C为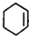 ,E、F为HCHO和CH3CHO,G为HOCH2CH2CHO,以甲苯、乙醛合成肉桂酸,可以用甲苯与氯气在光照条件下发生取代反应生成
,E、F为HCHO和CH3CHO,G为HOCH2CH2CHO,以甲苯、乙醛合成肉桂酸,可以用甲苯与氯气在光照条件下发生取代反应生成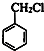 ,在碱性条件下水解生成
,在碱性条件下水解生成 ,发生催化氧化生成
,发生催化氧化生成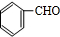 ,与乙醇发生加成反应生成
,与乙醇发生加成反应生成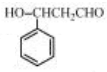 ,发生消去反应生成
,发生消去反应生成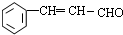 ,最后被银氨溶液氧化生成
,最后被银氨溶液氧化生成 .
.
解答 解:根据聚己二酸丙二醇酯( )的结构简式可知,D、H应为HOOC(CH2)4COOH和HOCH2CH2CH2OH,D是C被高锰酸钾氧化的产物,H是G被氢气还原的产物,所以D为HOOC(CH2)4COOH,H为HOCH2CH2CH2OH,根据题中转化关系可推得,A发生光照下取代反应生成一氯代烃B,B发生消去反应生成C,C发生氧化反应生成D,G与氢气发生加成反应生成H,信息④可知E与F反应生成G,所以可以确定,A的结构简式为
)的结构简式可知,D、H应为HOOC(CH2)4COOH和HOCH2CH2CH2OH,D是C被高锰酸钾氧化的产物,H是G被氢气还原的产物,所以D为HOOC(CH2)4COOH,H为HOCH2CH2CH2OH,根据题中转化关系可推得,A发生光照下取代反应生成一氯代烃B,B发生消去反应生成C,C发生氧化反应生成D,G与氢气发生加成反应生成H,信息④可知E与F反应生成G,所以可以确定,A的结构简式为 ,B为
,B为 ,C为
,C为 ,E、F为HCHO和CH3CHO,G为HOCH2CH2CHO,
,E、F为HCHO和CH3CHO,G为HOCH2CH2CHO,
(1)由上述分析可知,A的结构简式为 ,
,
故答案为: ;
;
(2)由E和F生成G的反应类型为加成反应,G为HOCH2CH2CHO,名称为:3-羟基丙醛,
故答案为:加成反应;3-羟基丙醛;
(3)①由D和H生成已二酸丙二醇酯的化学方程式为:n HOOC(CH2)4COOH+n HOCH2CH2CH2OH$→_{△}^{浓硫酸}$ +(2n-1)H2O,
+(2n-1)H2O,
故答案为:n HOOC(CH2)4COOH+n HOCH2CH2CH2OH$→_{△}^{浓硫酸}$ +(2n-1)H2O;
+(2n-1)H2O;
②聚已二酸丙二醇酯平均相对分子质量为5600,则其平均聚合度约为$\frac{5600-18}{12×9+16×4+14}$≈30,
故答案为:a;
(4)D为HOOC(CH2)4COOH,D的同分异构体中,能与饱和NaHCO3溶液反应产生气体,说明含有-COOH,既能发生银镜反应,又能发生水解反应,说明含有-OOCH,看作丁烷中2个H原子被-COOH、-OOCH取代,若为CH3CH2CH2CH3被取代,-COOH取代甲基中H原子,-OOCH有4种位置,-COOH取代亚甲基中H原子,-OOCH有4种位置,若为CH(CH3)3被取代,-COOH取代甲基中H原子,-OOCH有3种位置,-COOH取代次甲基中H原子,-OOCH有1种位置,故共有5+4+3+1=12种,其中核磁共振氢谱显示为4组峰,且峰面积比为6:1:1:2的一种结构简式为: ,
,
故答案为:12; ;
;
(5)甲苯与氯气在光照条件下发生取代反应生成 ,在碱性条件下水解生成
,在碱性条件下水解生成 ,发生催化氧化生成
,发生催化氧化生成 ,与乙醇发生加成反应生成
,与乙醇发生加成反应生成 ,发生消去反应生成
,发生消去反应生成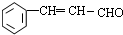 ,最后被银氨溶液氧化生成
,最后被银氨溶液氧化生成 ,合成路线流程图为:
,合成路线流程图为: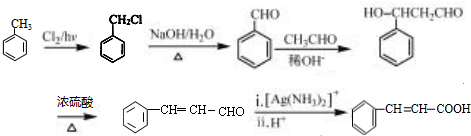 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,关键是计算确定A的结构简式,再结合反应条件进行推断,需要学生熟练掌握官能团的性质与转化,侧重分析与推断能力的综合考查,题目难度中等.

 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeI2):n(FeBr2)=3:1 | ||
| C. | 根据图象无法计算a的值 | D. | 线段Ⅳ表示IO${\;}_{3}^{-}$的变化情况 |
(1)合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H
①根据下表中有关化学键键能数据求算该反应的△H=-99kJ.mol-1
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)利用甲醇合成二甲醚的反应如下:2CH3OH(g)?CH3OCH3(g)+H2O(g),一定温度下,在三个体积均为1.0L的恒容密闭容器中发生该反应:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.若起始时项容器Ⅰ中充入0.1molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向正(填“正”或“逆”)反应方向进行
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的温度方面的措施是降低温度
(3)用甲醇电化学合成(CH3O)2CO的工作 原理如图所示
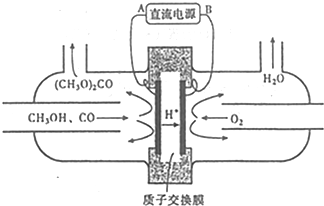
电源负极为B(填“A”或“B”),写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.若参加反应的O2为1.12m3(标准状况),则制得(CH3O)2CO的质量为9kg.
| A. | 坩埚主要用于给固体加热,可用坩埚将烧碱加热融化 | |
| B. | 明矾净水原理是吸附,不涉及化学变化 | |
| C. | 合成纤维和光导纤维都是新型无机非金属材料 | |
| D. | SO2与FeSO4溶液使酸性高锰酸钾的紫色褪去原理相同 |
| A. | 50 mL 12 mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| B. | 2 L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
| A. | Na和O2 | B. | Fe和稀HNO3 | C. | Cu和FeCl3溶液 | D. | Na2CO3和稀HCl |
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y) kJ•mol-1 |

| A. | 分子式为C14H18N2O3 | |
| B. | 水解产物中有两种氨基酸 | |
| C. | 在一定条件下既能与酸反应又能与碱反应 | |
| D. | 分子中有苯环、氨基、羧基、肽键和酯的结构 |
(1)某同学设计了从模拟海水中制备MgO的实验方案:
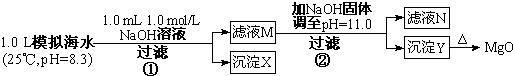
| 模拟海水中的 离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12
请回答:沉淀物X为CaCO3(写化学式);滤液N中存在的金属阳离子为Ca2+、Na+,;
步骤②中若改为加入 4.2gNaOH固体,沉淀物Y为Mg(OH)2(写化学式).
(2)物质的量为0.10mol的锂在只含有CO2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是0.7g<m<1.5g;
(3)锂电池是新一代高能电池,目前已研究成功多种锂电池.某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,则放电时电池的正极反应为CoO2+Li++e-=LiCoO2.
(4)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量AI、Fe等)可通过下列实验方法回收钴、锂.
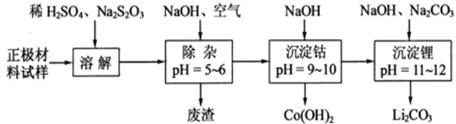
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为Na2S2O3+8LiCoO2+11H2SO4═4Li2SO4+8CoSO4+11H2O+Na2SO4.
②调整PH=5-6的目的是使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀除去.