题目内容
10.某课外活动小组实验测得某硅酸盐所含氧化物的质量分数如下表:| 氧化物 | CaO | Al2O3 | SiO2 | H2O |
| 质量分数 | 0.1420 | 0.2602 | 0.4592 | 0.1378 |
①普通化学式CaAl2Si3O10•3H2O(或CaAl2H6Si3O13);
②氧化物表示式CaO•Al2O3•3SiO2•3H2O.
分析 根据氧化物的质量可求出氧化物的个数比,根据个数比可求出普通化学式.
解答 N解:N(CaO):N(Al2O3):N(SiO2):N(H2O)=$\frac{0.1420}{56}$:$\frac{0.2602}{102}$=$\frac{0.4592}{60}$=$\frac{0.1378}{18}$=1:1:3:3,氧化物表示式:CaO•Al2O3•3SiO2•3H2O.
①根据氧化物表示式,可知普通化学式为CaAl2Si3O10•3H2O,故答案为:CaAl2Si3O10•3H2O(或CaAl2H6Si3O13);②氧化物表示式:CaO•Al2O3•3SiO2•3H2O,故答案为:CaO•Al2O3•3SiO2•3H2O.
点评 本题主要考查对化学用语的书写和理解能力以及有关物质的性质的运用,解答时须掌握硅酸盐改写成氧化物的方法,以及有关物质的化学性质.题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
20.体积为1L的干燥容器中充入一定量HCl气体后,测得容器中气体对氧气的相对密度为1.082.则容器中HCl气体的质量分数约为( )
| A. | 75% | B. | 25% | C. | 79.1% | D. | 78.1% |
1.下列属于天然高分子化合物的组合是( )
| A. | 天然橡胶、淀粉 | B. | 油脂、蛋白质 | C. | 塑料、纤维素 | D. | 蔗糖、淀粉 |
18. 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )
 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeI2):n(FeBr2)=3:1 | ||
| C. | 根据图象无法计算a的值 | D. | 线段Ⅳ表示IO${\;}_{3}^{-}$的变化情况 |
5.下列有关实验操作正确的是( )
| A. | 蒸馏实验中温度计的水银球应插入液态混合物中 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 分液时,打开旋塞,使下层液体从下口流出,上层液体从上口倒出 | |
| D. | 开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 |
15. 如图为美国布朗大学的科学家使用硅碲化物制造出的新型纳米颗粒材料,可广泛应用于电子和光学设备中.将该纳米颗粒分散到水中,下列有关该分散系的说法中正确的是( )
如图为美国布朗大学的科学家使用硅碲化物制造出的新型纳米颗粒材料,可广泛应用于电子和光学设备中.将该纳米颗粒分散到水中,下列有关该分散系的说法中正确的是( )
 如图为美国布朗大学的科学家使用硅碲化物制造出的新型纳米颗粒材料,可广泛应用于电子和光学设备中.将该纳米颗粒分散到水中,下列有关该分散系的说法中正确的是( )
如图为美国布朗大学的科学家使用硅碲化物制造出的新型纳米颗粒材料,可广泛应用于电子和光学设备中.将该纳米颗粒分散到水中,下列有关该分散系的说法中正确的是( )| A. | 该分散系属于溶液 | B. | 该分散系能产生丁达尔效应 | ||
| C. | 该分散系不能通过滤纸 | D. | 该分散系的隐定性强于食盐水 |
2.下列说法不正确的是 ( )
| A. | 具有较高能量的反应物分子称为活化分子 | |
| B. | 升高温度增大了活化分子百分数 | |
| C. | 化剂能够改变化学反应途径 | |
| D. | 增大压强能提高活化分子的浓度 |
11.回答下列有关重要化工原料甲醇的有关问题
(1)合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H
①根据下表中有关化学键键能数据求算该反应的△H=-99kJ.mol-1
②在T℃、恒容条件下,该反应的平衡常数Kp=6.0×10-3(kPa)-2.若起始时投入2molH2、1molCO,反应达到平衡时p(CH3OH)=24.0kPa,则平衡混合气体中CH3OH的物质的量分数约为44.4%(Kp是平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数).根据化学反应原理,分析增加压强对制备甲醇反应的影响增大压强使反应体系各组分浓度增大,反应速率加快,正反应为气体物质的量减小的反应,压强增大平衡正向移动,H2、CO的转化率增大,CH3OH的产率增大
(2)利用甲醇合成二甲醚的反应如下:2CH3OH(g)?CH3OCH3(g)+H2O(g),一定温度下,在三个体积均为1.0L的恒容密闭容器中发生该反应:
①$\frac{x}{y}$=$\frac{1}{2}$
②已知387℃时该反应的化学平衡常数K=4.若起始时项容器Ⅰ中充入0.1molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向正(填“正”或“逆”)反应方向进行
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的温度方面的措施是降低温度
(3)用甲醇电化学合成(CH3O)2CO的工作 原理如图所示
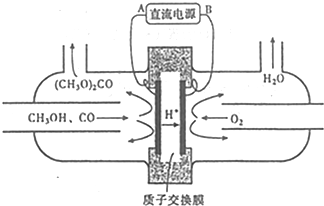
电源负极为B(填“A”或“B”),写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.若参加反应的O2为1.12m3(标准状况),则制得(CH3O)2CO的质量为9kg.
(1)合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H
①根据下表中有关化学键键能数据求算该反应的△H=-99kJ.mol-1
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)利用甲醇合成二甲醚的反应如下:2CH3OH(g)?CH3OCH3(g)+H2O(g),一定温度下,在三个体积均为1.0L的恒容密闭容器中发生该反应:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.若起始时项容器Ⅰ中充入0.1molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向正(填“正”或“逆”)反应方向进行
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的温度方面的措施是降低温度
(3)用甲醇电化学合成(CH3O)2CO的工作 原理如图所示

电源负极为B(填“A”或“B”),写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.若参加反应的O2为1.12m3(标准状况),则制得(CH3O)2CO的质量为9kg.
12.在25℃、1.01×105Pa下,将22g CO2通入到750mL 1.0mol•L-1的NaOH溶液中充分反应,放出x kJ热量.在该条件下1molCO2通入到2L 1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为( )
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y) kJ•mol-1 |