题目内容
3.设NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )| A. | 1molCl2参加反应转移电子数一定为2NA | |
| B. | 1mol甲烷分子所含质子数为10NA | |
| C. | 0.1molFe粉与足量水蒸气反应生成H2分子数为0.1NA | |
| D. | 含0.4molAl3+的Al2(SO4)3中含SO42-的物质的量是0.6NA |
分析 A、根据反应后氯元素的价态可能为-1价、+1价、+3价、+5价、+7价来分析;
B、甲烷为10质子分子;
C、依据铁与水蒸气反应计算氢气的物质的量;
D、由化学式可知,Al3+、SO42-的物质的量之比为2:3,据此计算.
解答 解:A、根据反应后氯元素的价态可能为-1价、+1价、+3价、+5价、+7价,故1mol氯气参与反应后转移的电子的个数不一定为2NA个,故A错误;
B、甲烷为10质子分子,故1mol甲烷中含10mol质子即10NA个,故B正确;
C、Fe粉与足量水蒸气反应的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;所以0.10molFe粉与足量水蒸气反应生成的H2分子数为$\frac{0.4}{3}$nA,故C错误;
D、由化学式可知,Al3+、SO42-的物质的量之比为2:3,0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是:0.4mol×$\frac{3}{2}$=0.6mol,故D正确;
故选BD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.下列属于天然高分子化合物的组合是( )
| A. | 天然橡胶、淀粉 | B. | 油脂、蛋白质 | C. | 塑料、纤维素 | D. | 蔗糖、淀粉 |
2.下列说法不正确的是 ( )
| A. | 具有较高能量的反应物分子称为活化分子 | |
| B. | 升高温度增大了活化分子百分数 | |
| C. | 化剂能够改变化学反应途径 | |
| D. | 增大压强能提高活化分子的浓度 |
11.回答下列有关重要化工原料甲醇的有关问题
(1)合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H
①根据下表中有关化学键键能数据求算该反应的△H=-99kJ.mol-1
②在T℃、恒容条件下,该反应的平衡常数Kp=6.0×10-3(kPa)-2.若起始时投入2molH2、1molCO,反应达到平衡时p(CH3OH)=24.0kPa,则平衡混合气体中CH3OH的物质的量分数约为44.4%(Kp是平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数).根据化学反应原理,分析增加压强对制备甲醇反应的影响增大压强使反应体系各组分浓度增大,反应速率加快,正反应为气体物质的量减小的反应,压强增大平衡正向移动,H2、CO的转化率增大,CH3OH的产率增大
(2)利用甲醇合成二甲醚的反应如下:2CH3OH(g)?CH3OCH3(g)+H2O(g),一定温度下,在三个体积均为1.0L的恒容密闭容器中发生该反应:
①$\frac{x}{y}$=$\frac{1}{2}$
②已知387℃时该反应的化学平衡常数K=4.若起始时项容器Ⅰ中充入0.1molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向正(填“正”或“逆”)反应方向进行
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的温度方面的措施是降低温度
(3)用甲醇电化学合成(CH3O)2CO的工作 原理如图所示
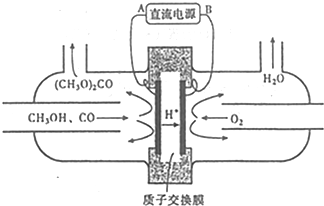
电源负极为B(填“A”或“B”),写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.若参加反应的O2为1.12m3(标准状况),则制得(CH3O)2CO的质量为9kg.
(1)合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H
①根据下表中有关化学键键能数据求算该反应的△H=-99kJ.mol-1
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)利用甲醇合成二甲醚的反应如下:2CH3OH(g)?CH3OCH3(g)+H2O(g),一定温度下,在三个体积均为1.0L的恒容密闭容器中发生该反应:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.若起始时项容器Ⅰ中充入0.1molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向正(填“正”或“逆”)反应方向进行
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的温度方面的措施是降低温度
(3)用甲醇电化学合成(CH3O)2CO的工作 原理如图所示

电源负极为B(填“A”或“B”),写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.若参加反应的O2为1.12m3(标准状况),则制得(CH3O)2CO的质量为9kg.
18.已知反应:A(g)+B(g)?C(g)+D(g)的平衡常数与温度的关系如下表.830℃时,向一个2L的密闭容器中充入0.2mol A和0.8mol B,反应至4s时c(C)=0.02mol/L.下列说法正确的是( )
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数K=0.4 | |
| B. | 反应达平衡后,升高温度,平衡正向移动 | |
| C. | 4s内,用A表示的该反应的平均反应速率v(A)=0.01mol/(L•s) | |
| D. | 830℃下反应达平衡时,B的转化率为20% |
8.下列说法正确的是( )
| A. | 坩埚主要用于给固体加热,可用坩埚将烧碱加热融化 | |
| B. | 明矾净水原理是吸附,不涉及化学变化 | |
| C. | 合成纤维和光导纤维都是新型无机非金属材料 | |
| D. | SO2与FeSO4溶液使酸性高锰酸钾的紫色褪去原理相同 |
15.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 50 mL 12 mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| B. | 2 L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
12.在25℃、1.01×105Pa下,将22g CO2通入到750mL 1.0mol•L-1的NaOH溶液中充分反应,放出x kJ热量.在该条件下1molCO2通入到2L 1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为( )
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y) kJ•mol-1 |
13.成语“恶狗酒酸”中隐藏着一个寓言故事:人有市酒而甚美者,然至酒酸而不售,问里人其故.里人曰:公之狗甚狂,人有持器往者,狗辄迎面啮之,是以酒酸不售也. 下列关于“酒”的说法错误的是( )
| A. | “恶狗酒酸”的成语中涉及了氧化反应 | |
| B. | 糖类、油脂都可以用来酿酒 | |
| C. | 葡萄糖转变成酒精的过程放出热量 | |
| D. | 工业酒精中因含有剧毒物质甲醇而不能用来勾兑饮用酒水 |