题目内容
氨气是中学化学中常见的气体,其用途广泛.
(1)实验室制取氨气的化学方程式是 .
(2)工业上氨气可以由氢气和氮气合成.
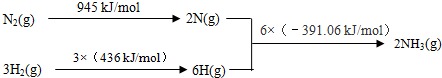
①该反应的热化学方程式是 .
②随着温度的升高,该反应的化学平衡常数的变化趋势是 .
③一定温度下,2L密闭容器中,5mol N2和5mol H2发生反应,达到平衡时,N2的转化率为20%,该温度下反应的平衡常数的数值是 .
④简述一种检查氨气是否泄露可采用的化学方法: .
(3)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气.
①写出氨水吸收SO2的化学反应方程式 .
②(NH4)2SO3显碱性,用化学用语和必要的文字解释其原因 .
(1)实验室制取氨气的化学方程式是
(2)工业上氨气可以由氢气和氮气合成.

①该反应的热化学方程式是
②随着温度的升高,该反应的化学平衡常数的变化趋势是
③一定温度下,2L密闭容器中,5mol N2和5mol H2发生反应,达到平衡时,N2的转化率为20%,该温度下反应的平衡常数的数值是
④简述一种检查氨气是否泄露可采用的化学方法:
(3)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气.
①写出氨水吸收SO2的化学反应方程式
②(NH4)2SO3显碱性,用化学用语和必要的文字解释其原因
考点:热化学方程式,化学平衡常数的含义,化学平衡的影响因素,二氧化硫的污染及治理
专题:基本概念与基本理论
分析:(1)实验室用硫化铵和氢氧化钙固体加热制取氨气;
(2)①先求出△H,△H=反应物键能和-生成物键能和即可写出热化学方程式;
②反应是放热反应,升温平衡向吸热反应方向进行,平衡逆向进行;
③结合化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算;
④利用氨气和HCl反应产生白烟,或者显碱性检查;
(3)①氨水吸收SO2的发生化学反应生成亚硫酸氢氨,结合原子守恒配平书写化学方程式;
②依据铵根离子和亚硫酸根离子水解程度大小比较分析判断溶液酸碱性;
(2)①先求出△H,△H=反应物键能和-生成物键能和即可写出热化学方程式;
②反应是放热反应,升温平衡向吸热反应方向进行,平衡逆向进行;
③结合化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算;
④利用氨气和HCl反应产生白烟,或者显碱性检查;
(3)①氨水吸收SO2的发生化学反应生成亚硫酸氢氨,结合原子守恒配平书写化学方程式;
②依据铵根离子和亚硫酸根离子水解程度大小比较分析判断溶液酸碱性;
解答:
解:(1)实验室用硫化铵和氢氧化钙固体加热制取氨气,反应方程式为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O,
故答案为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O;
(2)①△H=反应物键能和-生成物键能和=945KJ/mol+3×436KJ/mol-6×391.06KJ/mol=-93.36 kJ/mol,所以,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-93.36 kJ/mol;
2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-93.36 kJ/mol;
②计算可知反应是放热反应,升温,平衡逆向进行,平衡常数减小;
故答案为:减小;
③一定温度下,2L密闭容器中,5mol N2和5mol H2发生反应,达到平衡时,N2的转化率为20%,依据化学平衡三段式列式计算
N2(g)+3H2(g)?2NH3(g)
起始量(mol/L) 2.5 2.5 0
变化量(mol/L) 0.5 1.5 1.0
平衡量(mol/L) 2.0 1.0 1.0
平衡常数K=
=0.5
该温度下反应的平衡常数的数值是0.5;
故答案为:0.5;
④氨气和HCl反应产生白烟,并且显碱性,所以,检查氨气是否泄露可采用的化学方法有:将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露.(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露);
故答案为:将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露.(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露);
(3)①氨水吸收SO2的反应生成亚硫酸氢氨,反应化学方程式为:SO2+NH3?H2O=NH4HSO3;
故答案为:SO2+NH3?H2O=NH4HSO3;
②(NH4)2SO3显碱性是因为离子水解程度大小不同,NH4++H2O?NH3?H2O+H+,SO32-+H2O?HSO3-+OH-,SO32-水解程度大于NH4+的水解程度,溶液中氢氧根离子浓度大于氢离子浓度,溶液呈碱性;
故答案为:NH4++H2O?NH3?H2O+H+,SO32-+H2O?HSO3-+OH-,SO32-水解程度大于NH4+的水解程度,溶液中氢氧根离子浓度大于氢离子浓度,溶液呈碱性;
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)①△H=反应物键能和-生成物键能和=945KJ/mol+3×436KJ/mol-6×391.06KJ/mol=-93.36 kJ/mol,所以,其热化学方程式为:N2(g)+3H2(g)
 2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-93.36 kJ/mol;
2NH3(g)△H=-93.36 kJ/mol,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-93.36 kJ/mol;②计算可知反应是放热反应,升温,平衡逆向进行,平衡常数减小;
故答案为:减小;
③一定温度下,2L密闭容器中,5mol N2和5mol H2发生反应,达到平衡时,N2的转化率为20%,依据化学平衡三段式列式计算
N2(g)+3H2(g)?2NH3(g)
起始量(mol/L) 2.5 2.5 0
变化量(mol/L) 0.5 1.5 1.0
平衡量(mol/L) 2.0 1.0 1.0
平衡常数K=
| 12 |
| 2×13 |
该温度下反应的平衡常数的数值是0.5;
故答案为:0.5;
④氨气和HCl反应产生白烟,并且显碱性,所以,检查氨气是否泄露可采用的化学方法有:将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露.(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露);
故答案为:将湿润的红色石蕊试纸接近容器,观察试纸是否变蓝,如果变蓝说明有氨气泄露.(或蘸取浓盐酸接近容器,观察是否有白烟生成,如果有白烟生成说明管道泄露);
(3)①氨水吸收SO2的反应生成亚硫酸氢氨,反应化学方程式为:SO2+NH3?H2O=NH4HSO3;
故答案为:SO2+NH3?H2O=NH4HSO3;
②(NH4)2SO3显碱性是因为离子水解程度大小不同,NH4++H2O?NH3?H2O+H+,SO32-+H2O?HSO3-+OH-,SO32-水解程度大于NH4+的水解程度,溶液中氢氧根离子浓度大于氢离子浓度,溶液呈碱性;
故答案为:NH4++H2O?NH3?H2O+H+,SO32-+H2O?HSO3-+OH-,SO32-水解程度大于NH4+的水解程度,溶液中氢氧根离子浓度大于氢离子浓度,溶液呈碱性;
点评:本题考查了电化学、热化学、化学平衡常数计算、电解质溶液以及物质检验等等,考查范围广,难度一般,需要学生在学习过程中抓住基础.

练习册系列答案
相关题目
将6mol A和5mol B混合于4L恒容密闭容器中,发生如下反应:3A(g)+B(g)?nC(g)+2D(g),5s后反应达到平衡状态,生成2mol D,经测定以C表示的平均反应速率为0.1mol?L-1?s-1.则下列结论中正确的是( )
| A、5 s内以A表示的平均反应速率为0.15 mol?L-1?s-1 |
| B、平衡时,B的浓度为1 mol?L-1 |
| C、n值等于1 |
| D、平衡时B的转化率为50% |
 下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
 为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线.请分析讨论以下问题.
为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线.请分析讨论以下问题.