题目内容
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.已知:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ?mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJ?mol-1
2H2S(g)═2H2(g)+S2(g)△H=+169.8kJ?mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是
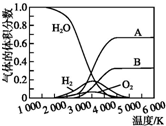
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示.图中A、B表示的物质依次是
考点:产物的百分含量随浓度、时间的变化曲线,热化学方程式
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据盖斯定律,利用已知热化学方程式乘以合适的系数进行加减,反应热也乘以相应的系数进行相应的计算,据此书写;
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量;
SO2与H2S进一步反应,生成物在常温下均非气体,二者反应生成S与H2O;
(3)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,据此判断.
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量;
SO2与H2S进一步反应,生成物在常温下均非气体,二者反应生成S与H2O;
(3)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,据此判断.
解答:
解:(1)已知:①CH4(g)+H2O(g)═CO(g)+3H2 (g)△H=-206.2kJ?mol-1
②CH4(g)+CO2 (g)═2CO(g)+2H2 (g)△H=-247.4kJ?mol-1
由盖斯定律,①×2-②得CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0 kJ?mol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0 kJ?mol-1;
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量,
SO2与H2S进一步反应,生成物在常温下均非气体,二者反应生成S与H2O,反应方程式为2H2S+SO2═2H2O+3S,
故答案为:为H2S热分解反应提供热量;2H2S+SO2═2H2O+3S;
(3)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,故A为氢原子、B为氧原子,
故答案为:氢原子、氧原子.
②CH4(g)+CO2 (g)═2CO(g)+2H2 (g)△H=-247.4kJ?mol-1
由盖斯定律,①×2-②得CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0 kJ?mol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0 kJ?mol-1;
(2)使部分H2S燃烧,放出热量,为H2S热分解反应提供热量,
SO2与H2S进一步反应,生成物在常温下均非气体,二者反应生成S与H2O,反应方程式为2H2S+SO2═2H2O+3S,
故答案为:为H2S热分解反应提供热量;2H2S+SO2═2H2O+3S;
(3)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,故A为氢原子、B为氧原子,
故答案为:氢原子、氧原子.
点评:本题考查了盖斯定律、根据方程式进行图象分析等知识点,根据盖斯定律书写热化学反应方程式,明确图象中各条曲线的含义,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、凡是中心原子采取sp3杂化的分子,其立体构形都是正四面体 |
| B、CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 |
| C、杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 |
| D、凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A、2-甲基丁烷 |
| B、2,2-二甲基丙烷 |
| C、2,2-二甲基丁烷 |
| D、2-甲基丙烷 |
某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )


| A、若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 |
| B、由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子 |
| C、由红外光谱可知,该有机物中至少有三种不同的化学键 |
| D、仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |