题目内容
甲烷是天然气的主要成分,是生产、生活中应用非常广泛的一种化学物质.
(1)在一定条件下,甲烷能发生如下反应:CH4(g)+H2O?CO(g)+3H2(g)△H>0
在其他条件不变的情况下降低温度,逆反应速率将 (填“增大”“减小”或“不变”)
现将1.0molCH4和2.0mol H2O(g)通入100L反应器中,发生上述反应,10min末有0.1mol CO生成,则v(H2)= .
(2)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
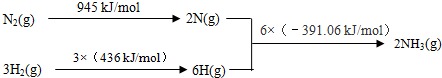
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H1
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H2
现有一份在相同条件下相对于也的密度为17的NO和NO2的混合气体,用16g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳和水蒸气,共放出1042.8kJ热量.
①该混合气体中NO和NO2的物质的量之比为 .
②已知上述热化学方程式中△H1=-1160kJ/mol,则△H2= .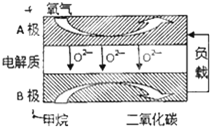
(3)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
①B电极的电极反应式为 .
②若用该燃料电池做电源,用石墨做电极电解100mL 2mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 L(标况下),而实际上消耗的甲烷体积(折算到标况)比理论值大,可能原因为 .(任答一条)
(1)在一定条件下,甲烷能发生如下反应:CH4(g)+H2O?CO(g)+3H2(g)△H>0
在其他条件不变的情况下降低温度,逆反应速率将
现将1.0molCH4和2.0mol H2O(g)通入100L反应器中,发生上述反应,10min末有0.1mol CO生成,则v(H2)=
(2)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H1
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H2
现有一份在相同条件下相对于也的密度为17的NO和NO2的混合气体,用16g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳和水蒸气,共放出1042.8kJ热量.
①该混合气体中NO和NO2的物质的量之比为
②已知上述热化学方程式中△H1=-1160kJ/mol,则△H2=

(3)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
①B电极的电极反应式为
②若用该燃料电池做电源,用石墨做电极电解100mL 2mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为
考点:化学电源新型电池,反应热和焓变,化学反应速率的影响因素
专题:基本概念与基本理论
分析:(1)根据温度对速率的影响分析;根据CO的变化量求出CO的速率,再根据计量数之比等于速率比求出氢气的速率;
(2)①相同条件下,不同气体的摩尔质量之比等于其密度之比,据此计算氮氧化物平均摩尔质量,再根据平均摩尔质量计算NO和二氧化氮的物质的量之比;
②根据盖斯定律确定甲烷和二氧化氮之间的方程式,根据甲烷和NO、NO2之间的反应确定分别和NO、NO2之间反应需要甲烷的物质的量之比,再根据焓变进行计算;
(3)①Ⅲ(1)B为负极,总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减可得负极电极反应式;
②开始阶段发生反应:2Cu2++2H2O
2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O
2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒列方程计算,再根据电子转移守恒计算消耗的甲烷;根据电池中的能量转化率分析.
(2)①相同条件下,不同气体的摩尔质量之比等于其密度之比,据此计算氮氧化物平均摩尔质量,再根据平均摩尔质量计算NO和二氧化氮的物质的量之比;
②根据盖斯定律确定甲烷和二氧化氮之间的方程式,根据甲烷和NO、NO2之间的反应确定分别和NO、NO2之间反应需要甲烷的物质的量之比,再根据焓变进行计算;
(3)①Ⅲ(1)B为负极,总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减可得负极电极反应式;
②开始阶段发生反应:2Cu2++2H2O
| ||
| ||
解答:
解:(1)降低速率,正逆反应速率都减小;10min末有0.1mol CO生成,则v(CO)=
=1×10-4mol/(L?min),则氢气的速率为v(H2)=3v(CO)=3×10-4mol/(L?min),
故答案为:减小;3×10-4mol/(L?min);
(2)①在相同条件下对H2的相对密度为17的NO与NO2的混合气体,相同条件下,气体的密度之比等于其摩尔质量之比,所以混合气体的摩尔质量为34g/mol,设n(NO)为x,n(NO2)为y,
混合气体摩尔质量=
=34g/mol,x:y=3:1,
故答案为:3:1;
②16g甲烷的物质的量=
=1mol,
根据盖斯定律知,CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H1
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g);△H=0.5(△H1+△H2)
NO和NO2的物质的量之比为3:1,根据方程式知,当NO和NO2完全转化为氮气时,分别和NO、NO2反应的甲烷的物质的量之比=
:
=3:2,则有0.6mol甲烷和NO反应、0.4mol的甲烷和NO2反应,
0.6mol甲烷和NO反应放出的热量=0.6mol×1160kJ/mol=696kJ,0.4mol甲烷和NO2完全反应放出的热量=1042.8kJ-696kJ=346.8kJ,则0.4mol甲烷和NO2完全反应放出的热量=0.5(△H1+△H2)×0.4mol=0.2mol×(1160kJ/mol+△H2)=346.8kJ,则△H2=
=-574 kJ/mol,
故答案为:-574 kJ/mol;
(3)①总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减,负极反应为:CH4-8e-+4O2-=CO2+2H2O,
故答案为:CH4-8e-+4O2-=CO2+2H2O;
②硫酸铜的物质的量=0.1L×2mol/L=0.2mol,开始阶段发生反应:2Cu2++2H2O
2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O
2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒,则:0.2mol×2+2x=4x,解得x=0.2,
根据电子转移守恒,可知消耗的甲烷物质的量=
=0.1mol,故消耗甲烷的体积=0.1mol×22.4L/mol=2.24L,
原电池中发生反应时化学能不去全部转化为电能,即电池能量转化率达不到100%,所以实际上消耗的甲烷的体积比理论上大;
故答案为:2.24L;电池能量转化率达不到100%.
| ||
| 10min |
故答案为:减小;3×10-4mol/(L?min);
(2)①在相同条件下对H2的相对密度为17的NO与NO2的混合气体,相同条件下,气体的密度之比等于其摩尔质量之比,所以混合气体的摩尔质量为34g/mol,设n(NO)为x,n(NO2)为y,
混合气体摩尔质量=
| 30xg+46yg |
| (x+y)mol |
故答案为:3:1;
②16g甲烷的物质的量=
| 16g |
| 16g/mol |
根据盖斯定律知,CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H1
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g);△H=0.5(△H1+△H2)
NO和NO2的物质的量之比为3:1,根据方程式知,当NO和NO2完全转化为氮气时,分别和NO、NO2反应的甲烷的物质的量之比=
| 3 |
| 4 |
| 1 |
| 2 |
0.6mol甲烷和NO反应放出的热量=0.6mol×1160kJ/mol=696kJ,0.4mol甲烷和NO2完全反应放出的热量=1042.8kJ-696kJ=346.8kJ,则0.4mol甲烷和NO2完全反应放出的热量=0.5(△H1+△H2)×0.4mol=0.2mol×(1160kJ/mol+△H2)=346.8kJ,则△H2=
| 346.8kJ |
| 0.2mol |
故答案为:-574 kJ/mol;
(3)①总反应式为CH4+2O2+=CO2+2H2O,正极反应式为:2O2+8e-=4O2-,两式相减,负极反应为:CH4-8e-+4O2-=CO2+2H2O,
故答案为:CH4-8e-+4O2-=CO2+2H2O;
②硫酸铜的物质的量=0.1L×2mol/L=0.2mol,开始阶段发生反应:2Cu2++2H2O
| ||
| ||
根据电子转移守恒,可知消耗的甲烷物质的量=
| 0.2mol×4 |
| 8 |
原电池中发生反应时化学能不去全部转化为电能,即电池能量转化率达不到100%,所以实际上消耗的甲烷的体积比理论上大;
故答案为:2.24L;电池能量转化率达不到100%.
点评:本题综合考查了反应速率的计算、反应热的计算、电化学知识等,题目整体计算量较大,侧重于对基础知识综合应用的考查,题目难度中等.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池,下列有关判断正确的是( )
| A、负极发生的电极反应可能是:O2-4e-+2H2O═4OH- |
| B、正极发生的电极反应可能是:O2-4e-═2O2- |
| C、负极反应主要是C6H12O6生成CO2或HCO3- |
| D、正极反应主要是C6H12O6生成CO2或CO32- |
为了确定几种物质化学性质活泼性强弱,某同学做了如下实验:有A、B、C、D四种金属,A、B与酸反应放出氢气,C、D不能;A与B接触放在潮湿空气中,B被腐蚀;将C浸入D的盐溶液,C表面有D析出.则四种金属的化学性质由强到弱的顺序是( )
| A、A、B、C、D |
| B、B、A、C、D |
| C、B、A、D、C |
| D、C、D、B、A |