题目内容
(1)如图1,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
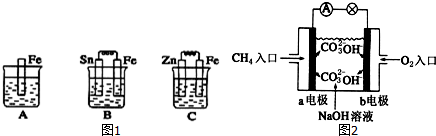
①B中Sn极的电极反应式为 ;Sn极附近溶液的pH将 (填“增大”、“减小”或“不变”).
②C中总反应离子方程式为 ;比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 .
(2)如图2是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是 (填“a”或“b”),该极的电极反应是: .
②电池工作一段时间后电解质溶液的pH (填“增大”、“减小”或“不变”).

①B中Sn极的电极反应式为
②C中总反应离子方程式为
(2)如图2是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是
②电池工作一段时间后电解质溶液的pH
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)①该装置中,铁易失电子作负极,Sn作正极,正极上氢离子放电生成氢气;根据氢离子浓度变化确定溶液pH变化;
②该装置中,锌易失电子作负极、Fe作正极,实质上相当于锌和氢离子之间的置换反应;作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护;
(2)①燃料电池中,通入燃料的电极是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据电池反应式确定溶液pH变化.
②该装置中,锌易失电子作负极、Fe作正极,实质上相当于锌和氢离子之间的置换反应;作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护;
(2)①燃料电池中,通入燃料的电极是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据电池反应式确定溶液pH变化.
解答:
解:(1)①该装置中,铁易失电子作负极,Sn作正极,正极上氢离子放电生成氢气,电极反应为2H++2e-=H2↑,消耗H+,pH增大,故答案为:2H++2e-=H2↑;增大;
②该装置中,锌易失电子作负极、Fe作正极,实质上相当于锌和氢离子之间的置换反应,电池反应式为Zn+2H+=Zn2++H2↑;作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,A发生化学腐蚀,B中Fe为负极,Sn为正极,Fe被腐蚀,C中Zn为负极,Fe为正极,Fe被保护,则A、B、C中铁被腐蚀的速率,由快到慢的顺序是B、A、C,
故答案为:Zn+2H+=Zn2++H2↑;
(2)①燃料电池中,通入燃料的电极是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,所以a电极是负极,电极反应式为CH4-8e-+10OH-═CO32-+7H2O,故答案为:a;CH4-8e-+10OH-═CO32-+7H2O;
②在碱性溶液中,甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,溶液中氢氧根离子被消耗,导致溶液的pH减小,故答案为:减小.
②该装置中,锌易失电子作负极、Fe作正极,实质上相当于锌和氢离子之间的置换反应,电池反应式为Zn+2H+=Zn2++H2↑;作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,A发生化学腐蚀,B中Fe为负极,Sn为正极,Fe被腐蚀,C中Zn为负极,Fe为正极,Fe被保护,则A、B、C中铁被腐蚀的速率,由快到慢的顺序是B、A、C,
故答案为:Zn+2H+=Zn2++H2↑;
(2)①燃料电池中,通入燃料的电极是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,所以a电极是负极,电极反应式为CH4-8e-+10OH-═CO32-+7H2O,故答案为:a;CH4-8e-+10OH-═CO32-+7H2O;
②在碱性溶液中,甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,溶液中氢氧根离子被消耗,导致溶液的pH减小,故答案为:减小.
点评:本题考查了原电池原理,根据金属失电子难易、物质得失电子确定原电池正负极,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,难度中等.

练习册系列答案
相关题目
某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )


| A、若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 |
| B、由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子 |
| C、由红外光谱可知,该有机物中至少有三种不同的化学键 |
| D、仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
为了确定几种物质化学性质活泼性强弱,某同学做了如下实验:有A、B、C、D四种金属,A、B与酸反应放出氢气,C、D不能;A与B接触放在潮湿空气中,B被腐蚀;将C浸入D的盐溶液,C表面有D析出.则四种金属的化学性质由强到弱的顺序是( )
| A、A、B、C、D |
| B、B、A、C、D |
| C、B、A、D、C |
| D、C、D、B、A |
25℃时,水的电离可达到平衡:H2O?H++OH-△H>0,下列叙述正确的是( )
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C、向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D、将水加热,Kw增大,pH变小,但仍呈中性 |
在下列有机物中,不能跟溴水发生加成反应但能被酸性高锰酸钾溶液氧化的是( )
| A、乙烯 | B、苯 | C、甲苯 | D、乙烷 |
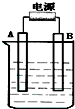 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题: