题目内容
在微生物作用下,NH4+经过两步反应被氧化成NO3-.反应的能量变化示意图如下:
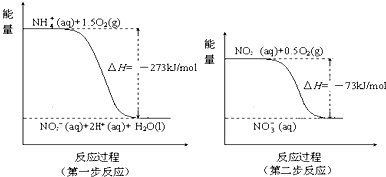
①第一步反应是 反应(选填“放热”或“吸热”),判断依据是 .
②1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是 .

①第一步反应是
②1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是
考点:反应热和焓变
专题:化学反应中的能量变化
分析:①当反应物的总能量大于生成物的总能量,反应是放热的;
②结合图象根据盖斯定律来计算反应的焓变.
②结合图象根据盖斯定律来计算反应的焓变.
解答:
解:①焓变小于0,则反应为放热反应,故答案为:放热;因为△H=-273kJ/mol<0(反应物的总能量大于生成物的总能量);
②第一步的热化学方程式为NH4+(aq)+1.5O2(g)═NO2-(aq)+2H+(aq)+H2O(l),△H=-273KJ/mol,第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq),△H=-73KJ/mol,根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol
,故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.
②第一步的热化学方程式为NH4+(aq)+1.5O2(g)═NO2-(aq)+2H+(aq)+H2O(l),△H=-273KJ/mol,第二步的热化学方程式为:NO2-(aq)+0.5O2(g)═NO3-(aq),△H=-73KJ/mol,根据盖斯定律则NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol
,故答案为:NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.
点评:本题是一道有关化学反应中的能量变化和热化学方程式的题目,综合性强,难度较大.

练习册系列答案
相关题目
要得到较大颗粒的明矾晶体,在结晶时可如下操作( )
| A、配制比室温高10~20℃明矾饱和溶液然后浸入悬挂的明矾小晶核,静置过夜 |
| B、在沸水中配制明矾饱和溶液,然后急速冷却结晶 |
| C、室温下,在明矾饱和溶液中投入明矾小晶核,静置过夜 |
| D、进行快速蒸发明矾饱和溶液至大量晶体析出 |
近年来,加“碘”食盐较多使用碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为KI+H2O→KIO3+H2↑(未配平).下列有关说法中,正确的是( )
| A、电解时,石墨做阴极,铁作阳极 |
| B、电解时,在阳极上产生氢气 |
| C、电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧 |
| D、电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体 |
下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A、2-甲基丁烷 |
| B、2,2-二甲基丙烷 |
| C、2,2-二甲基丁烷 |
| D、2-甲基丙烷 |

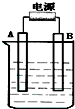 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题: