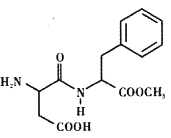
题目内容
【题目】下列实验事实不能用平衡移动原理解释的是
A. pH=11的氨水稀释10倍后溶液pH>10
B. 将氯化铝溶液加热蒸干并灼烧,最终得氧化铝固体
C. 对2HI(g)![]() H2(g)+I2(g),减小容器体积,气体颜色变深
H2(g)+I2(g),减小容器体积,气体颜色变深
D. 水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除
【答案】C
【解析】
A、本来稀释10倍碱性变弱10倍,pH应该是10.但是,氨水属于弱碱,弱碱部分电离,NH3.H2O![]() NH4++OH-加水稀释平衡正向移动,碱性稍大些,所以比10大些,但大不过11,故A 能用平衡移动原理解释;
NH4++OH-加水稀释平衡正向移动,碱性稍大些,所以比10大些,但大不过11,故A 能用平衡移动原理解释;
A、铝离子在水溶液中发生水解,AlCl3+3H2O![]() Al(OH)3+3HCl↑,加热条件下氯化氢逐渐挥发,平衡正向移动,氢氧化铝受热易分解,2Al(OH)3=Al2O3+3H2O,所以把氯化铝溶液蒸干,灼烧,最后得到的主要固体产物是氧化铝,故A能用平衡移动原理解释;
Al(OH)3+3HCl↑,加热条件下氯化氢逐渐挥发,平衡正向移动,氢氧化铝受热易分解,2Al(OH)3=Al2O3+3H2O,所以把氯化铝溶液蒸干,灼烧,最后得到的主要固体产物是氧化铝,故A能用平衡移动原理解释;
C、对2HI(g)![]() H2(g)+I2(g)反应前后气体的物质的量没有变化,改变压强不会使平衡发生移动,而减小容器体积,气体颜色变深,是因为体积变小,碘蒸汽的密度增大,导致颜色加深,故C不能用平衡移动原理解释;
H2(g)+I2(g)反应前后气体的物质的量没有变化,改变压强不会使平衡发生移动,而减小容器体积,气体颜色变深,是因为体积变小,碘蒸汽的密度增大,导致颜色加深,故C不能用平衡移动原理解释;
D、因为溶解度S(CaCO3)<S(CaSO4),故水垢中的CaSO4时,加入饱和Na2CO3溶液,能将CaSO4转化为CaCO3,后加盐酸,水垢溶解,从而除去水垢,故D能用平衡移动原理解释;
综上所述,本题正确答案为C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表为元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
四 | ⑨ | ⑩ |
(1)写出元素符号:②________,⑦_______。
(2)①的原子结构示意图为_________,⑤的离子结构示意图为________。
(3)元素⑨的最高价氧化物对应的水化物的电子式为________。
(4)元④、⑧、⑩的氢化物的沸点由高到低的顺序为_________(填化学式)。
(5)写出元素③和⑥形成的化合物与元素⑤的最高价氧化物对应的水化物反应的化学方程式_____________。