题目内容
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)如图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
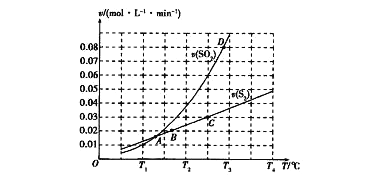
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
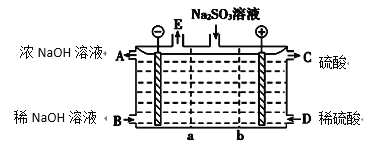
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。
①a表示________(填“阴”或“阳”)离子交换膜。A~E分别代表生产中的原料或产品,其中A为浓氢氧化钠溶液,C为硫酸溶液,E表示________(写化学式)。
②电解过程中,阳极的电极反应式为_______________________________________。
【答案】CH4(g)+2SO2(g)=2S(g)+CO2(g)+2H2O(g) H=+352 kJ/mol C < A 阳 H2 SO32--2e-+H2O=2H++SO42-
【解析】
(1)依据图像和盖斯定律进行推算;
(2)①达到平衡状态时,速率之比等于计量数之比,且速率方向相反,依据正逆反应速率相等判断;
②从图像可以看出,温度升高,SO2的生成速率较快,反应向逆向移动,故该反应为放热反应,H![]() ;
;
③对于2C(s)+2SO2(g) ![]() S2(g)+2CO2(g) H
S2(g)+2CO2(g) H![]() ;的可逆反应,依据勒夏特列原理进行分析既得答案;
;的可逆反应,依据勒夏特列原理进行分析既得答案;
(3)由C为硫酸,可知阳极反应式为SO32--2e-+H2O===SO42-+2H+,A为浓NaOH,阴极反应式为2H2O+2e-===H2↑+2OH-,依据电解池原理分析即可;
(1)由图像可知①CH4(g)![]() 2O2(g)=CO2(g)
2O2(g)=CO2(g)![]() 2H2O(g)
2H2O(g) ![]() H=-802KJ/mol, ②S(s)
H=-802KJ/mol, ②S(s)![]() 2O2(g)=SO2(g)
2O2(g)=SO2(g) ![]() H=-577KJ/mol,依据盖斯定律①-2
H=-577KJ/mol,依据盖斯定律①-2![]() ②可以得到:CH4(g)
②可以得到:CH4(g)![]() 2SO2(g)= CO2(g)
2SO2(g)= CO2(g)![]() 2 S(s)
2 S(s)![]() 2 H2O(g)
2 H2O(g) ![]() H=+352KJ/mol,;
H=+352KJ/mol,;
本题答案为:CH4(g)+2SO2(g)=2S(g)+CO2(g)+2H2O(g) H=+352 kJ/mol;
(2)①达到平衡状态时,SO2(g)和S2(g)速率之比等于计量数之比,且速率方向相反,A点时,SO2(g)的生成速率和S2(g)的生成速率相等,不符合计量数关系,没有达到平衡状态;B点时,SO2(g)的生成速率和S2(g)的生成速率不相等,但不符合计量数比关系,没有达到平衡状态;C点时,SO2(g)的生成速率和S2(g)的生成速率不相等,但符合计量数比关系,达到平衡状态;D点时,SO2(g)的生成速率和S2(g)的生成速率不相等,但不符合计量数比关系,没有达到平衡状态;
②从图像可以看出,温度升高,SO2的生成速率较快,反应向逆向移动,故该反应为放热反应,H![]() ;
;
对于2C(s)+2SO2(g) ![]() S2(g)+2CO2(g) H
S2(g)+2CO2(g) H![]() ;的可逆反应,
;的可逆反应,
A.降低温度,平衡向正向移动,SO2平衡转化率增大,故A正确;
B.C是固体,改变其用量,平衡不移动,SO2平衡转化率不变,故B错误;
C. 减小容器体积,平衡向逆向移动,SO2平衡转化率减小,故C错误;
D. 添加高效催化剂,只能加快反应速率,平衡不移动,SO2平衡转化率不变,故D错误;
本题答案为:C,![]() ,A;
,A;
(3)由C为硫酸,可知阳极反应式为SO2--2e-+H2O===SO42-+2H+,故b为阴离子交换膜,A为浓NaOH,阴极反应式为2H2O+2e-===H2↑+2OH-,Na+要移至阴极区,故a为阳离子交换膜。E是H2;
本题答案为:阳,H2,SO32--2e-+H2O===SO42-+2H+。

 探究与巩固河南科学技术出版社系列答案
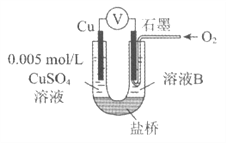
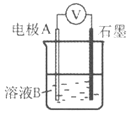
探究与巩固河南科学技术出版社系列答案【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| I | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验I中铁主要发生了析氢腐蚀,其负极反应式是__________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是__________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是__________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
V | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验II、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、V进行比较,其目的是探究__________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、V重复进行实验,其设计意图是_________;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是__________。