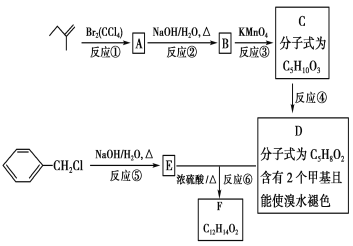
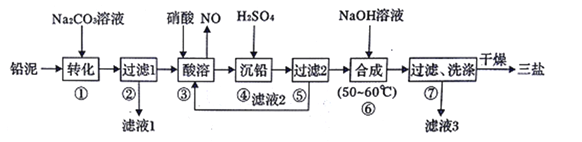
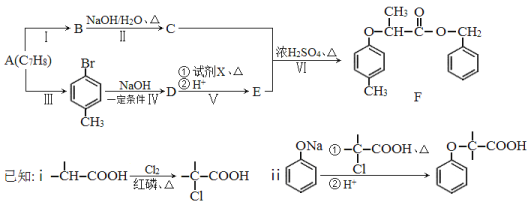
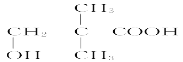题目内容
【题目】在一个容积为2L的密闭容器内进行如下反应:A2(g)+3B2(g)=aX(g)。反应开始时,n(A2)=1.5mol,n(B2)= 4.0mol,2min后,n(B2)=0.4mol, n(X)=2.4mol。
请计算:
(1)a值_______。
(2)X的表示式(用A、B表示)_______。
(3)2min末A2的浓度________。
(4)B2的化学反应速率为_______。
(5)2min末B2的转化率为_______。
【答案】2 AB3 0.15 mol/L 0.9 mol/(L·min) 90%
【解析】
根据物质的量的变化比等于化学计量数之比求出a,根据反应前后各种元素的原子个数相等求出X的表示式,带入化学反应速率计算公式计算反应速率,2min末△c(A2)=![]() △c(B2)=
△c(B2)=![]() =0.6mol/L,根据化学反应速率的定义式计算V(A2),离子不同物质反应速率比等于化学计量数的比计算V(B2),利用物质的转化率等于
=0.6mol/L,根据化学反应速率的定义式计算V(A2),离子不同物质反应速率比等于化学计量数的比计算V(B2),利用物质的转化率等于![]() ×100%计算2min末B2的转化率。
×100%计算2min末B2的转化率。
(1)在2min内△n(B2)=4.0mol-0.4mol=3.6mol,△n(X)=2.4mol,根据物质的量的变化比等于化学计量数之比可知:△n(B2):△n(X)=3.6mol:2.4mol=3:2=3:a,所以a=2;
(2)根据质量守恒定律即反应前后各种元素的原子个数相等可知X的表达式为AB3;
(3)根据方程式中物质转化关系可知△n(A2):△n(B2)=1:3,△n(B2)=3.6mol,则△n(A2)=![]() △n(B2)=
△n(B2)=![]() △n(B2)=1.2mol,所以2min末A2的浓度c(A2)=
△n(B2)=1.2mol,所以2min末A2的浓度c(A2)=![]() =0.15mol/L;
=0.15mol/L;
(4)B2的化学反应速率为V(B2)=![]() =0.9 mol/(L·min);
=0.9 mol/(L·min);
(5)2min末B2的转化率为![]() ×100%=90%。
×100%=90%。

 阅读快车系列答案
阅读快车系列答案【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
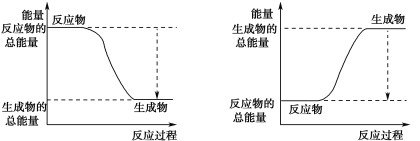
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
【题目】根据下列实验操作和现象能推出相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向NaAlO2溶液中滴加NaHCO3 溶液,产生白色沉淀 | AlO2-与HCO3-发生了相互促进的水解反应 |
B | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X不一定具有氧化性 |
C | 灼热的木炭加入浓硝酸中,放出红棕色气体 | 一定是木炭与浓硝酸反应生成了NO2 |
D | 将乙醇与浓硫酸共热,制得的气体直接通入酸性KMnO4溶液中,酸性KMnO4溶液褪色 | 说明制得的气体中含有乙烯 |
A. A B. B C. C D. D